Jméno lékaře, pracoviště: MUDr. Eva Jánská, FN Plzeň, I. Interní klinika, odd. gastroenterologie a hepatologie
Anamnéza celková: Pacientka 48 let, interně dosud nestonající
Anamnéza IBD: Ulcerozní kolitida extenzivní tvar, prvozáchyt na spádové GE ambulanci v r. 2013
Anamnéza farmakologická: bez trvalé medikace
Popis případu:
Do péče naší GE ambulance převzata v r. 2014 s velmi těžkým nálezem hemorrhagicko – ulcerozního postižení tračníku, s malnutricí, váhovým úbytkem 20kg za 6 měsíců, s anemickým syndromem, s nutností hospitalizace. Léčena zvykle KS, ATB, uvedena do remise. Kontrolní endoskopie jen s mírnou hyperemií sliznice tračníku, udržovací léčba 5-ASA celkově a lokálně.
Další relaps s hemorrhagicko – ulcerozním postižením v 2/2015, opět nutná hospitalizace. Pro těžký endoskopický nález a rozvoj kortikoresistence nutno zahájit IS cyklosporinem z důvodu potřeby rychlého nástupu účinku. Přechodně zlepšena. 4/ 2015 komplikována uzávěrem kmene v. saphena parva LDK s potřebou antikoagulační léčby LMWH do 8/2015.
8/2015 další těžký relaps s frekventními průjmy s krví, bolestmi břicha, endoskopicky ulcerozní postižení s inkompletní zánětlivou stenózou sigmoidea, bez tendence k hojení i při léčbě cyklosporinem. Navíc rozvoj renální insuficience jako NÚ cyklosporinu. Cyklosporin vysazen a zahájena BT infliximabem.
Ani takto nebyla kompletní remise navozena, trvá chronická aktivita, nepříznivý endoskopický nález hemorrhagicko-ulcerozního postižení. Nově se objevují recidivující perianální abscesy, aktivní perianální fistule s opakovanými chirurgickými intervencemi a drenáží, současně i mimostřevní kloubní postižení i při pokračující biologické léčbě infliximabem (hladina IXF dostatečná, protilátky negat.).
Pro trvale vysokou zánětlivou aktivitu endoskopicky, laboratorně a klinicky, s celkovým strádáním, bolestmi břicha, stolicemi s krví 7-10x denně, subfebriliemi, významným váhovým úbytkem, sekundární anemií, žádáno 6/2017, tehdy ještě na §16, o vedolizumab a zahájena léčba. Již od 2. dávky výrazné zlepšení, 12/2017 po 3. dávce vedolizumabu výrazná regrese endoskopického nálezu, sliznice postupně bez ulcerací, stolice se upravují, jsou bez krve, pacientka bez bolestí břicha či jiných obtíží, přibírá na váze, postupně regreduje i perianální postižení, celkově se cítí velmi dobře. Navozena kompletní remise endoskopická, klinická i laboratorní, která trvá od konce r. 2017 dosud.
Závěr: Jde o 48letou pacientku s těžkou formou UC, s chronickou aktivitou onemocnění, s opakovanými relapsy, hospitalizacemi, rozvojem kortikoresistence, s přetrvávajícím těžkým hemorrhagicko ulcerozním postižením tračníku, s recidivujícími perianálními fistulemi a abscesy, s neúčinností imunosupresiv i anti TNF alfa (tehdy vedolizumab schvalován až v druhé linii). Remise navozena krátce po podání indukční léčby vedolizumabem. Kompletení remise, bez relapsů, dalších komplikací či vedlejších účinků, s výbornou kvalitou života, trvá dosud, tedy téměř 5 let.
Obrázky:
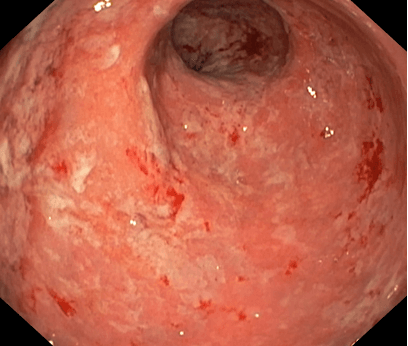
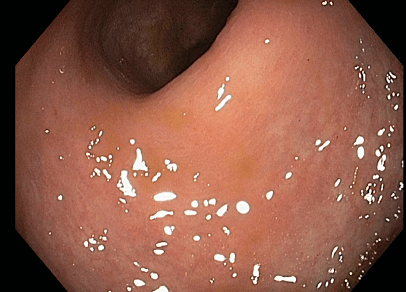
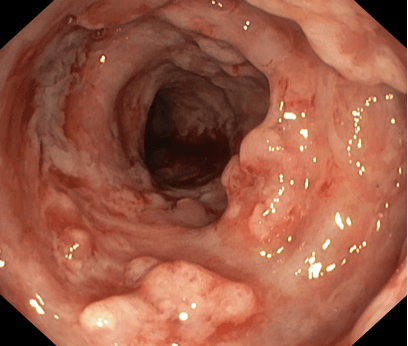
Zdroj: databáze autora
Datum přípravy: červen 2022
C-APROM/CZ/ENTY/0082
ENTYVIO
Zkrácené informace o přípravku:
Název: Entyvio 300 mg prášek pro koncentrát pro infuzní roztok (i.v.). Entyvio 108 mg injekční roztok v předplněném peru (s.c.). Složení: Entyvio 300 mg: Jedna injekční lahvička obsahuje vedolizumabum 300 mg. Po rekonstituci jeden ml obsahuje vedolizumabum 60 mg. Seznam pomocných látek viz SPC. Entyvio 108 mg: Jedno předplněné pero obsahuje vedolizumabum 108 mg v 0,68 ml. Seznam pomocných látek viz SPC. Indikace: Entyvio i.v. + s.c. Léčba dospělých pacientů se středně těžkou až těžkou aktivní ulcerózní kolitidou (UC) nebo se středně těžkou až těžkou aktivní Crohnovou chorobou (CD), u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují. Entyvio i.v.: indikován k léčbě dospělých pacientů se středně těžkou až těžkou aktivní chronickou pouchitidou, kteří podstoupili proktokolektomii s ileopouch-anální anastomózou v rámci léčby ulcerózní kolitidy a mají nedostatečnou odpověď na antibiotickou léčbu nebo na ni přestali odpovídat. Dávkování a způsob podání: Entyvio 300 mg: Doporučená dávka je 300 mg podávaných i.v. infuzí v týdnu 0, 2 a 6, a dále pak každých 8 týdnů (viz SPC); Entyvio 108 mg: Subkutánně podávaný vedolizumab (108 mg) je určen pro udržovací léčbu podávanou po alespoň 2 intravenózních infuzích, každé 2 týdny (viz SPC). Bezpečnost a účinnost vedolizumabu u dětí ve věku od 0 do 17 let nebyla dosud stanovena. U starších pacientů se úprava dávkování nevyžaduje. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Aktivní závažné infekce, jako jsou tuberkulóza, sepse, cytomegalovirus, listerióza, a oportunní infekce, jako je progresivní multifokální leukoencefalopatie (PML). Zvláštní upozornění: U pacientů, kterým byl podáván vedolizumab, byly hlášeny reakce související s infuzí (IRR) nebo reakce v místě aplikace a hypersenzitivní reakce. Existuje potenciální zvýšené riziko oportunních infekcí nebo infekcí, pro něž je střevo ochrannou bariérou. Před zahájením léčby musí být pacienti vyšetřeni na tuberkulózu. Souběžné používání přípravku s biologickými imunosupresivy se nedoporučuje. Při léčbě se může pokračovat v očkování neživými vakcínami. Entyvio 300 mg: Všechny pacienty je třeba nepřetržitě sledovat během každé infuze a dále přibližně 1 hodinu (u prvních 2 infuzí 2 hodiny) po ukončení infuze. Lékové interakce: Společné podávání kortikosteroidů, imunomodulátorů a aminosalicylátů nemá klinicky významný účinek na farmakokinetiku vedolizumabu. Živé vakcíny, zejména perorální živé vakcíny, je nutno s vedolizumabem používat s opatrností. Nežádoucí účinky: Nejčastěji hlášenými nežádoucími účinky jsou infekce (jako jsou nazofaryngitida, infekce horních cest dýchacích, bronchitida, chřipka a sinusitida), bolest hlavy, nauzea, pyrexie, únava, kašel, artralgie. Byly také hlášeny reakce v místě injekce nebo v místě aplikace. Ostatní viz SPC. Zvláštní požadavky na podmínky uchovávání: Entyvio 300 mg:Injekční lahvičku nutno chránit před světlem, uchovávejte v chladničce (2 °C - 8 °C) Entyvio 108 mg: Nutno chránit před světlem, Uchovávejte v chladničce (2 °C - 8 °C) Chraňte před mrazem. Předplněné pero je možno ponechat mimo chladničku v původní krabičce při pokojové teplotě (až do 25 °C) po dobu až 7 dnů. Držitel rozhodnutí o registraci: Takeda Pharma A/S, Delta Park 45, 2665 Vallensbaek Strand, Dánsko. Registrační číslo: EU/1/14/923/001,005-007. Datum poslední revize: Entyvio s.c. – 3/2024. Datum poslední revize Entyvio i.v. – 3/2024
Přípravek Entyvio 300 mg je v indikaci CD a UC hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Přípravek Entyvio 108 mg je hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Před předepsáním se seznamte s úplným zněním Souhrnů údajů o přípravcích.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na SÚKL nebo společnosti Takeda emailem na AE.CZE@takeda.com

