MUDr. Paula Morávková, Ph.D., II. Interní gastroenterologická klinika
Lékařská fakulta v Hradci Králové, UK a Fakultní nemocnice Hradec Králové
Anamnéza:
Rodinná anamnéza: otec arteriální hypertenze a hypercholesterolémie, matka – zdravá, jedna sestra – polyvalentní alergie, jinak zdravá
Osobní anamnéza: Ulcerózní kolitida, diagnostikovaná v roce 2000, rozsahem pankolitida, E3 dle Montréalské klasifikace
- Kortikodependence
- Selhání konvenční imunosupresivní léčby
- Ztráta odpovědi na infliximab s rozvojem fulminantní kolitidy ve 3. trimestru gravidity v r. 2016
- Sekundární non-respondér na adalimumab
- vedolizumab od 5/2019
Ostatní dg.: klostridiová kolitida 12/2012, elevace funkčních jaterních testů, ANF +++, homogenní typ, anti dsDNA negat. – v.s. vliv gravidity v r.2011, zánět zrakového nervu vlevo 2000, operace tříselné kýly vpravo 1985, infekce covid-19 v 10/2020 – dokončené očkování
Sociální anamnéza: pracuje jako účetní, aktuálně převážně práce z domova
Abusus: nekuřák, alkohol nepije
Farmakologická anamnéza: vedolizumab 108 mg S.C.. á 14 dní, mesalazin 400 mg p.o. 4-0-4, calcium s vitaminem D3 600/400 IU p.o. 1-0-1, kyselina listová 10 mg p.o. 1-0-0, vit.D p.o. 30 kapek/týdně
Popis případu:
Jedná se o 43letou ženu s diagnózou ulcerózní kolitidy od roku 2000. V letech 2003-2009 byla opakovaně léčená systémovými kortikosteroidy, které se nepovedlo dlouhodobě vysadit ani při současné konvenční imunosupresivní terapii azathioprinem. Kortikodependentní průběh nemoci a selhání konvenční imunosuprese bylo indikací k zahájení biologické léčby infliximabem v roce 2009, která vedla k dosažení remise ulcerózní kolitidy. Stav byl provázený významnou hepatopatií, která si vynutila přerušení biologické léčby. To vedlo k dalšímu relapsu ulcerózní kolitidy. Onemocnění již hůře reagovalo na reindukci infliximabu, opět si vyžádalo léčbu systémovými kortikosteroidy. Intenzifikace biologické léčby zkrácením dávkovacího režimu (aplikace infliximab 5mg/kg á 6 týdnů) umožnila postupné ukončení systémových kortikosteroidů. Ty nebylo nutné vracet do léčby až do doby rozvoje fulminantní kolitidy ve 3. trimestru gravidity v roce 2016 i přesto, že biologická léčba v graviditě nebyla přerušena. Byla indikovaná změna biologické léčby v rámci skupiny inhibitorů TNF-α. Léčba adalimumabem vedla k významnému zlepšení endoskopického nálezu a dosažení klinické remise. Od roku 2018 postupně projevy relapsu onemocnění, vzestup CRP a fekálního kalprotektinu, dle koloskopie obraz těžké pankolitidy s plazivými ulceracemi v tračníku. V té době byla opakovaně zamítnuta žádost o schválení léčby vedolizumabem na §16. Nižší sérová hladina adalimumabu (5 g/ml), absence protilátek proti adalimumabu a vyčerpané možnosti terapie byly důvodem k intenzifikaci režimu podávání biologické léčby a opětovné léčbě systémovými kortikosteroidy jako poslední krok před zvažovanou kolektomií. Přesto nebylo dosaženo slizničního zhojení, laboratorně přetrvávaly vysoké hladiny fekálního kalprotektinu (> 1800 ug/g st.). V květnu 2019 byl proveden swap biologické léčby na vedolizumab. Po nasazení vedolizumabu bylo dosaženo setrvalé remise s kompletním zhojením kolitidy, které je doloženo při opakovaných dispenzárních koloskopických kontrolách, jsou setrvale nízké hladiny fekálního kalprotektinu (< 30 ug/g st.) a nebyl zaznamenán žádný relaps onemocnění, který by si vyžádal léčbu systémovými či topickými kortikosteroidy. V únoru 2022 byla pacientka úspěšně a doposud bez komplikací převedena na s.c. aplikovaný vedolizumab.
Recentní práce dokládají účinnost vedolizumabu u pacientů v minulosti exponovaných léčbou anti-TNF- α a s.c. aplikace vedolizumabu je efektivní v udržení remise u pacientů, u kterých byla zaznamenaná klinická odpově na i.v. podání vedolizumabu (1,2).
Zobrazovací metody:
Koloskopie 2009: těžká kolitida s postižením transverza, ascendens a céka (ulcerace, zánětlivé polypy, petechie), pozánětlivé změny v sigmatu a descendens (jizvy), mírná proktitida (granulovaná sliznice), normální nález v terminálním ileu. Histologie: obraz středně aktivní ulcerózní kolitidy. Obr.1
Sigmoideoskopie 2016: endoskopický obraz těžké kolitídy ve vyšetřeném úseku rekta a sigmatu (granulace, edém sliznice, mělké ulcerace, nálety hlenohnisu). Histologie: těžká akutně exacerb. kolitída bez průkazu CMV. Obr.2
Koloskopie 2018: endoskopický obraz těžké pankolitídy (plazivé ulcerace, tubulizace transversa, vymizelé haustrace), termin. ileum s norm. nálezem. Histologie: známky středně těžké aktivní kolitidy s porušenou architektonikou, která může z morfologického hlediska spadat do rámce ulcerózní kolitidy. Ani v jednom odběru není patrná pozitivita CMV. Obr.3
Koloskopie 2021: Ulcerózní kolitida – bez makroskopických známek aktivity nemoci, pozánětlivé změny v celém tračníku (jizvení), nález je kompletně zhojený. Obr.4
Reference:
- Sands BE, Peyrin-Biroulet L, Loftus EV Jr, Danese S, Colombel JF, Törüner M, Jonaitis L, Abhyankar B, Chen J, Rogers R, Lirio RA, Bornstein JD, Schreiber S; VARSITY Study Group. Vedolizumab versus Adalimumab for moderate-to-severe ulcerative colitis. N Engl J Med 2019; 381(13): 1215-1226.
- Sandborn WJ, Baert F, Danese S, Krznarić Ž, Kobayashi T, Yao X, Chen J, Rosario M, Bhatia S, Kisfalvi K, D’Haens G, Vermeire S. Efficacy and safety of vedolizumab subcutaneous formulation in a randomized trial of patients with ulcerative colitis. Gastroenterology 2020; 158(3): 562-572.
Obrázky:
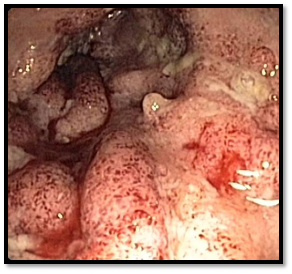
Obr.1: Kolitída v roce 2009 před zahájením léčby infliximabem
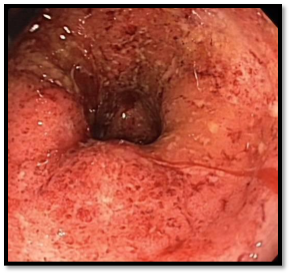
Obr.2: Fulminantní kolitída v roce 2016
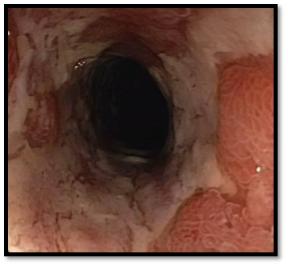
Obr.3: Plazivé ulcerace v tračníku při relapsu v roce 2018
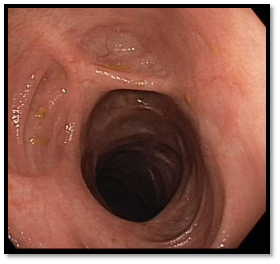
Obr.4: Kontrolní koloskopie v roce 2021 – kompletní zhojení, jizvení na sliznici a defomace střevního lumen, bez významné stenózy
C-APROM/CZ/ENTY/0116

