Autor článku: MUDr. Veronika Hrubá, ISCARE, a.s.
Anamnéza:
Pacientka nar. 1951 (70 let)
St.p. cholecystektomii 1976, arteriální hypertenze od 2001, hyperlipidémie
Nekuřačka
Anamnéza farmakologická:
felodipin, hydrochlorothiazid/amlodipin (oboje od roku 2001), fenofibrát, kolestyramin
Popis případu:
Obtíže od roku 1991, průjmy, bolesti břicha hubnutí, 1992 dg. Crohnovy choroby (CN).
První operace v roce 1993: ileokolická resekce pro stenózu Bauhinské chlopně, pooperačně až do roku 2015 bez léčby.
V květnu 2015 při koloskopickém vyšetření zjištěna stenóza IK anastomózy, dle MR enterografie zánětlivé postižení 30cm neoterminálního ilea. Nasazen topický kortikoid budenosid, po kterém vznikly otoky v oblasti krku a obličeje. Pro obstrukční obtíže bylo provedeno kontrolní koloskopické vyšetření s nálezem těsné stenózy v anastomóze, proto pacientka odeslána k chirurgickému vyšetření.
V lednu 2016 provedena re-resekce anastomózy a 40cm neoterminálního ilea. Po operaci bez terapie. Při kontrolní koloskopii v září 2016 zjištěna recidiva CN na neoterminálním ileu a v oblasti anastomózy se stenózou, která byla endoskopicky dilatována (viz obr. 1).
V říjnu 2016 byla pacientka zařazena do studie Versify (vedolizumab v léčbě CN), podávaným á 8 týdnů po dobu 52 týdnů. Léčba byla efektivní (viz obr. 2), proto od listopadu 2017 pacientka pokračovala v open label studii s vedolizumabem z důvodu nedostupnosti komerčního vedolizumabu. Po schválení zdravotní pojišťovnou v červnu 2019 byla převedena na terapii Entyvio.
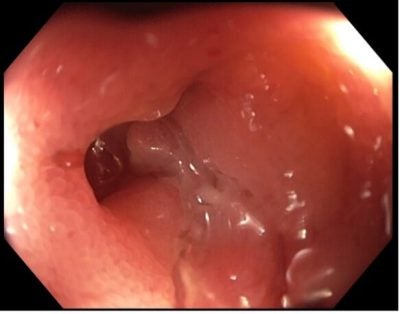
Obr. 1: Recidiva CN se stenózou ileo-kolické anastomózy po operaci v r.2016
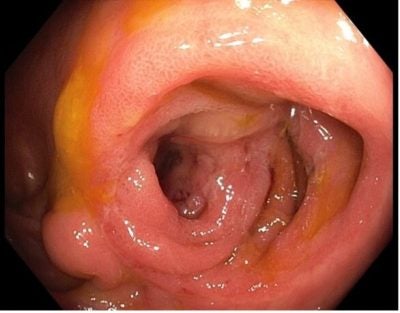
Obr. 2: Ileokolická anastomóza při koloskopii v r.2017
Od ledna do dubna 2021 došlo přechodně k intenzifikaci podávání vedolizumabu na á 4 týdny pro elevaci fekálního kalprotektinu (FC 1305 µg/g), pacientka byla bez výraznějších klin. obtíží. Při další kontrole došlo k opětnému poklesu FC k norm. hodnotám (138 µg/g), proto jsme se v dubnu 2021 navrátili ke standardnímu dávkování. Pro špatný žilní přístup byla pacientka v květnu 2021 převedena na s.c. podávání 108 mg á 2 týdny ve kterém pokračuje doposud.
V současné době je pacientka ve stabilizovaném stavu, nemá bolesti břicha, dodržuje pouze částečnou bezezbytkovou dietu. Její váha je stabilní – 54 kg při výšce 159 cm (BMI 21.4), má 1-2 stolice denně při užívání kolestyraminu. Hladina vedolizumabu se pohybuje mezi 50-60 mg/l, protilátky proti vedolizumabu jsou trvale negativní.
Závěr:
Jedná se o 70-letou pacientku s Crohnovou nemocí, která v minulosti prodělala 2 resekční výkony v ileokolické oblasti. Pro recidivu CN v oblasti anastomózy je od roku 2016 léčena vedolizumabem (1. linie biologické léčby), v posledních 8 měsících v subkutánní formě pro špatný žilní přístup.
Po celou dobu léčby (nyní 5 let) je v klinické remisi bez nutnosti dalšího operačního výkonu.
C-APROM/CZ/ENTY/0045

