Autor článku: MUDr. Dominik Wrožyna, Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice
Úvod: Prezentujeme kasuistiku polymorbidního pacienta seniorního věku s dlouholetou anamnézou kortikodependentní ulcerózní kolitidy. Jedná se o nemocného s vysoce rizikovými komorbiditami-kardiaka (dlouhodobě funkčně NYHA III) po katetrizační náhradě aortální chlopně pro fibrotické postižení na duální antiagreagační léčbě a obecně s lékovou polypragmázii. Dále hypertonika, hyperlipidemika a diabetika na inzulinoterapii po cévní mozkové příhodě v minulosti s přetrvávající mírnou levostrannou hemiparézou. Pro rozvoj kortikodependence a vysoce rizikový profil pacienta bylo přistoupeno k biologické léčbě vedolizumabem v první linii s následným rozvojem klinické, laboratorní i endoskopické remise.
Popis případu: 76letý pacient byl od roku 2011 sledován ve spádové gastroenterologické ambulanci pro enterorhagii a váhový úbytek. Při koloskopickém vyšetření byl v levé části tračníku nalezen obraz odpovídající ulcerózní kolitidě s plošnými, místy i cirkulárními vředy (Mayo endoskopické skóre 3). Histologické zhodnocení potvrdilo přítomnost kryptových abscesů a přiklonilo se k diagnóze ulcerózní kolitidy. Pacient byl indikován k perorální i lokální léčbě mesalazinem (v dávce 4 gramy denně per os a 1 gram ve formě čípku nebo nálevu) a perorální léčbě systémovými kortikosteroidy v dávce 1mg/kg v deeskalačním schématu. Na výše uvedené terapii se klinický i laboratorní stav pacienta zlepšil, ale v následujících letech došlo k několika klinickým i endoskopickým exacerbacím zánětu, vždy s nutnosti podání systémové kortikoterapie a následným rozvojem kortikodependence s nemožností snížit dávku prednisonu pod 20mg denně.
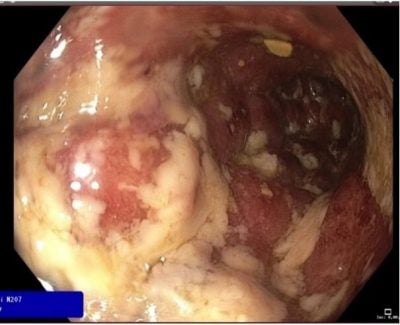
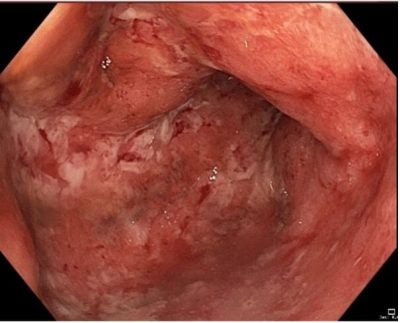
V roce 2018 byl nemocný odeslán do gastroenterologické ambulance Centra péče o zažívací trakt ke zvážení biologické léčby. Ve vstupních laboratorních odběrech krve byly patrné známky aktivní ulcerózní kolitidy (normocytární hypochromní anémie s hodnotou hemoglobinu 103 g/l, CRP 61,2 mg/l, celkové leukocyty 12,3 109/l, hodnota fekálního kalprotektinu 2110 µg/g). Klinicky dominovaly urputné tenesmy, plynatost a při snížení kortikosteroidů pod 20mg/den i rozvoj četných krvavých stolic v počtu nad 10 denně. V rámci verifikace tíže postižení kolon byla doplněna kontrolní koloskopie, kde byl stanoven rozsah a stupeň aktivity poškození a odebrány biopsie k histologickému posouzení a vyloučení cytomegalovirové střevní infekce. Koloskopie potvrdila těžkou aktivitu ulcerózní kolitidy, nyní již v rozsahu celého tračníku a byla provádějícím gastroenterologem klasifikována jako Mayo endoskopické skóre 3 (obr.č.1,2). Pacient byl prezentován na IBD komisi za přítomnosti ošetřujícího gastroenterologa, chirurga, radiologa a nutricionisty s domluvou o dalším postupu v terapii. Byly důkladně zvažovány veškeré možnosti léčby a bylo přihlédnuto k pacientovým komorbiditám i věku. Nemocný byl pro svůj věk kontraindikován k imunosupresivní terapii azathioprinem a pro rizikový kardiální profil nebylo možno nasadit ani anti-TNF-α biologickou léčbu. Po zvážení všech dostupných možností léčby bylo přistoupeno k prvoliniové biologické léčbě vedolizumabem.
Léčba vedolizumabem byla zahájena v červnu 2019 ve standartním indukčním režimu (300mg vedolizumabu intravenózní infuzí v týdnu 0, 2 a 6) a pokračovala v udržovacím režimu co 8týdnů. Při další kontrole v gastroenterologické ambulanci v lednu roku 2020 pacient popisuje výrazné zlepšení zdravotního stavu, ultrasonografie střeva verifikovala dominantně chronické změny stěny celého tračníku s jen minimální známkou aktivity v oblasti sigmatu. Laboratorně dochází k normalizace hemogramu, poklesu CRP na hodnotu 10 mg/l a fekálního kalprotektinu na 350 µg/g. Kontrolní koloskopie byla provedena v květnu 2020 s nálezem chronických změn sliznice s patrnou tubulizací tračníku a jen drobným izolovaným úsekem zarudnutí v oblasti přechodu rekta a sigmatu. Stav jsme zhodnotili jako dosažení klinické, endoskopické a laboratorní remise a v zavedené terapii pokračujeme nadále.
Obr. č. 1, 2. Endoskopický obraz těžkých zánětlivých změn v levé části tračníku
Pozn. Archiv autora
C-APROM/CZ/ENTY/0045

