IBD: Crohnova nemoc
Název kazuistiky: Sonografie v diagnostice komplikací Crohnovy nemoci – popis klinického případu.
Jméno lékaře, pracoviště: MUDr. Naděžda Machková, Klinické a výzkumné centrum pro střevní záněty, ISCARE a.s., Praha
Anamnéza a popis případu: Pacient narozený v roce 1992, bez závažných onemocnění v rodinné i osobní anamnéze, nekuřák. Ve 13 letech věku byla diagnostikována Crohnova nemoc (CN) s postižením terminálního ilea a céka (A1, L3, B2). Přes zavedenou konzervativní léčbu mesalazinem, systémovými kortikosteroidy a azathioprinem u pacienta dlouhodobě přetrvávala mírná aktivita nemoci. Pro těsnou stenózu v oblasti céko−ascendens a skip léze na terminálním ileu v celkové délce postižení 18 cm byl v roce 2015 indikován k operační léčbě. V srpnu 2015 byla na Chirurgické klinice ÚVN v Praze provedena laparoskopicky asistovaná pravostranná hemikolektomie s ileokolickou anastomózou typu side-to-side. Pooperačně pacient pokračoval v terapii azathioprinem v dávce 125mg/den. Při kontrolní koloskopii 6 měsíců po operaci byla diagnostikována ulcerace v široké anastomóze po předchozí pravostranné hemikolektomii a normální endoskopický nález na tračníku i v neoterminálním ileu (Rutgeerts i2). Léčba azathioprinem byla ukončena v říjnu 2019 pro recidivující herpes zoster. Vzhledem ke klinické, laboratorní a endoskopické remisi byl pacient nadále ponechán bez medikamentózní terapie.
V říjnu 2022 byl hospitalizován na Interním oddělení pro rozvoj ileózního stavu po dietní chybě. CT břicha prokázalo mírné zánětlivé změny v oblasti ileokolické (IK) anastomózy s prosáknutím okolních tkání a mezenteriální lymfadenopatii. Při infuzní terapii, parenterální aplikaci antibiotik (ciprofloxacin a metronidazol) a systémových kortikosteroidů (methylprednisolon) došlo k rychlé úpravě stavu. Následně provedená koloskopie diagnostikovala stenotickou, pro endoskop neprostupnou IK anastomózu s objemnou ulcerací zahrnující ¾ cirkumference, nález na tračníku byl normální (obrázek č.1). Vzhledem k velikosti ulcerace nebylo možno provést endoskopickou intervenci stenózy. Při MR enterografii byla popsána krátká stenóza v oblasti anastomózy s obrazem zánětlivé infiltrace, bez prestenotické dilatace, bez nálezu dalších skip lézí na tenkém střevě. 8.11.2022 byla zahájena biologická léčba infliximabem ve standardní dávce 5mg/kg v týdnu 0,2, 6 a dále pokračováno v aplikaci po 8 týdnech.
V průběhu ledna 2023 měl pacient opakovaně křečovité bolesti břicha narůstající intenzity. 27.1.2023 byl na našem pracovišti akutně vyšetřen pro subileózní stav. Laboratorní výsledky byly v normě, bez elevace zánětlivých markerů. Při sonografickém vyšetření břicha byla popsána krátká, zánětlivá stenóza IK anastomózy s prestenotickou dilatací lumen na 38 mm a stagnací střevního obsahu (obrázek č.2 a 3). Pacient byl indikován ke kontrolní koloskopii, která byla provedena 3.2.2023 s nálezem těsné stenózy anastomózy (obrázek č.4). Následně byl zaveden metalický Hanaro stent délky 6 cm (obrázek č.5). Kontrolní sonografie po výkonu potvrdila dobrou polohu stentu a dostatečnou šíři anastomózy (obrázek č.6). Pro bolesti břicha byl Hanaro stent extrahován po 5 dnech. Anastomóza po extrakci stentu byla volně prostupná, v neoterminálním ileu byl nalezen dekubitální vředovitý defekt a proliferace sliznice polypoidního vzhledu v úseku 35-40 mm (obrázek č.7 a 8).
Po výkonu byla provedena změna terapie na vedolizumab ve standardním režimu dávkování. Aktuálně pacient nemá žádné klinické potíže, laboratorní výsledky jsou v normě. Kontrolní sonografie střev 3 měsíce po odstranění stentu prokazuje šíři anastomózy 10,9 mm s volnou průchodností střevního obsahu, bez dilatace lumen orálně od IK anastomózy.
Komentář:
V uvedené kazuistice je popsána možnost využití kombinace střevní sonografie (IUS) a koloskopie v diagnostice, léčbě a následném sledování pacienta s CN se stenózou anastomózy po předchozím resekčním výkonu. Endoskopie s odběrem biopsií a histologickým vyšetřením je základní diagnostickou metodou u idiopatických střevních zánětů (IBD). Nicméně má své limitace obzvláště v diagnostice komplikací. Pro zhodnocení celkového postižení jsou hlavně u pacientů s CN nutná doplňující zobrazovací vyšetření jako CT, magnetická rezonance nebo sonografie. Využití střevní sonografie u IBD v posledních letech významně narůstá. V porovnání s ostatními zobrazovacími metodami nemá sonografické vyšetření žádnou kontraindikaci a není zatíženo radiačním zářením. Pro pacienta je komfortní, nevyžaduje žádnou přípravu a lze ho neomezeně opakovat. Vyšetření v reálném čase tzv. Point-of-Care Ultrasound (POCUS) umožňuje lékaři rychlé rozhodnutí o dalším diagnostickém a léčebném postupu. U pacientů s CN má IUS vysokou diagnostickou přesnost v určení lokalizace, extenze a aktivity onemocnění, souvisejících komplikací (stenózy, abscesy, píštěle), v hodnocení odpovědi na léčbu a v detekci pooperační recidivy. Stenózy jsou u pacientů s CN nejčastější intraabdominální komplikací a indikací k operační léčbě. Sonografie umožnuje diagnostiku stenóz střevního lumen i anastomózy po předchozích resekčních výkonech. Senzitivita IUS v diagnostice stenóz se pohybuje mezi 80-100 % a specificita 63-75 %. V sonografickém obraze je stenóza charakterizována zesílenou, tuhou stěnou, zúžením lumen <10 mm a prestenotickou dilatací lumen ≥ 25 mm. Pomocí IUS lze posoudit délku stenózy, její šířku a průchodnost střevního obsahu. Dle stratifikace a vaskularizace střevní stěny lze usuzovat i na charakter stenózy (převahu zánětlivé či fibrózní složky), což má význam pro rozhodnutí o způsobu další léčby.
Obrázky ke kazuistice s popisem
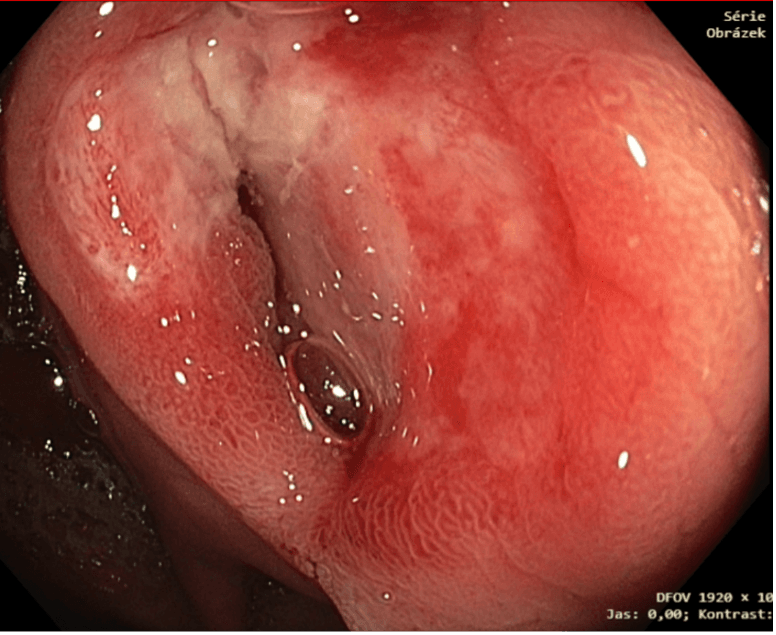
Obrázek 1. Stenotická IK anastomóza s objemnou ulcerací (snímek MUDr. Martin Lukáš, ISCARE)
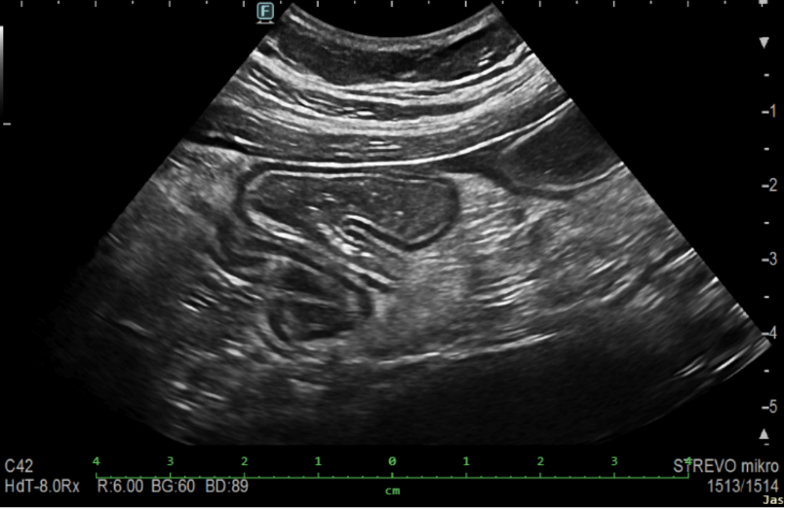
Obrázek 2. Zánětlivá stenóza IK anastomózy (šipka)
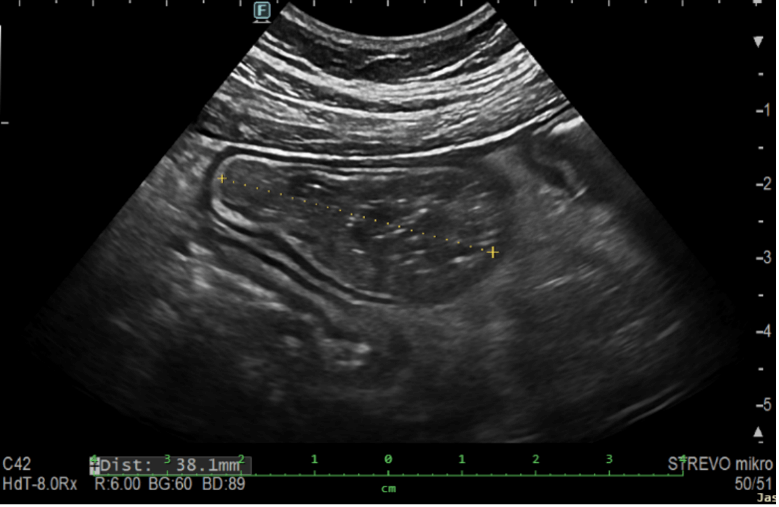
Obrázek 3. Prestenotická dilatace ilea 38,1 mm
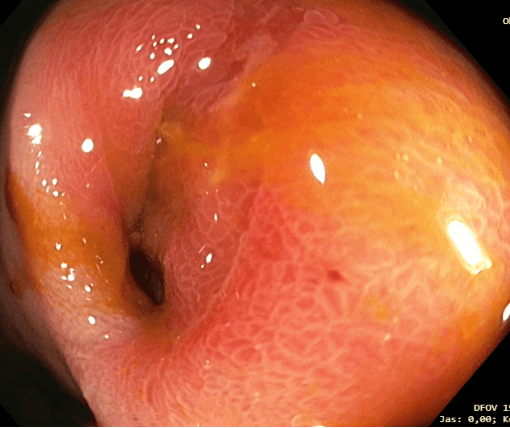
Obrázek 4. Těsná stenóza IK anastomózy (snímek MUDr. Martin Lukáš, ISCARE)
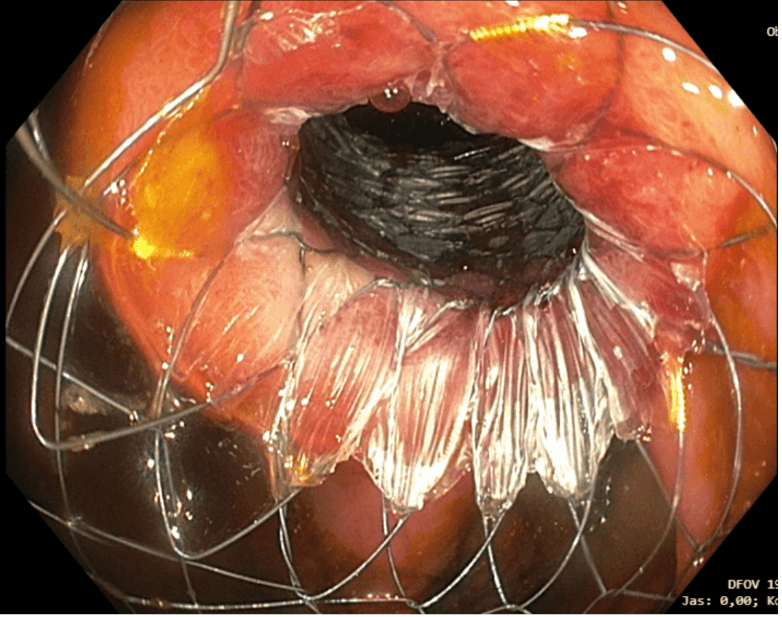
Obrázek 5. IK anastomóza po zavedení metalického Hanaro stentu (snímek MUDr. Martin Lukáš, ISCARE)
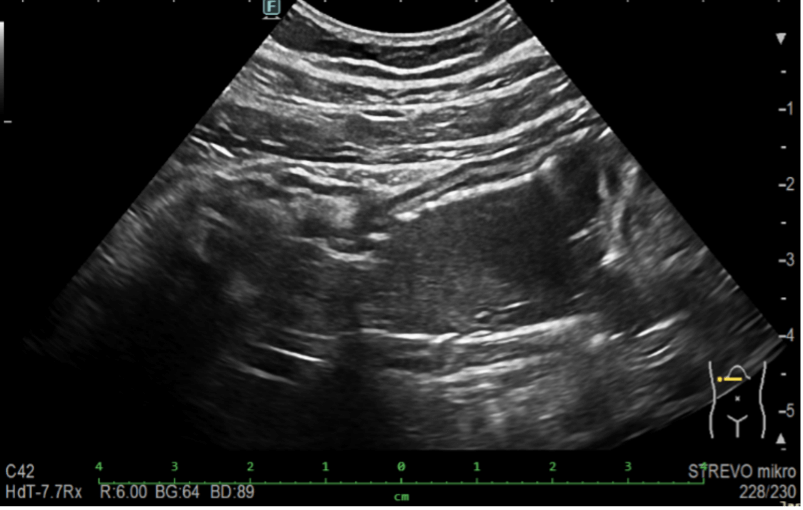
Obrázek 6. Dilatovaná stenóza IK anastomózy (křížky) se zavedeným Hanaro stentem (šipky)
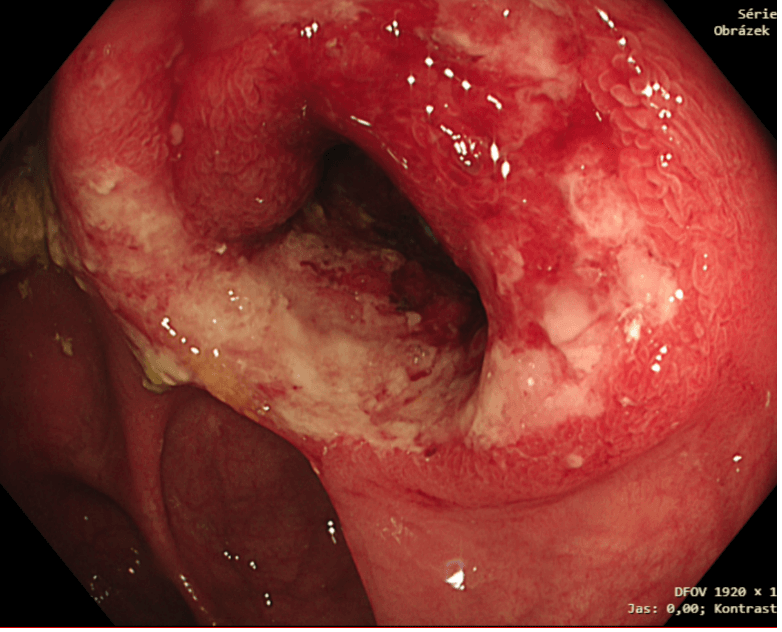
Obrázek 7. Anastomóza s dekubitální ulcerací po extrakci stentu (snímek MUDr. Martin Lukáš, ISCARE)
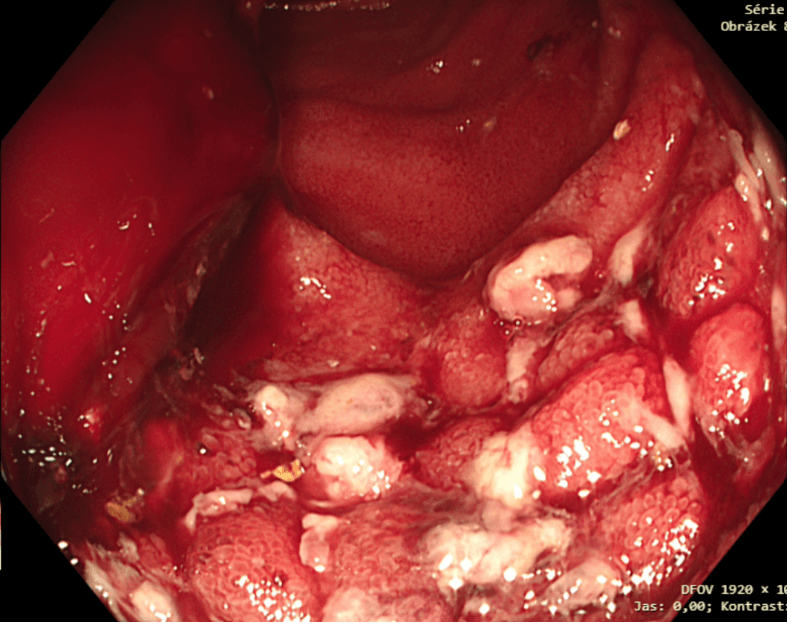
Obrázek 8. Proliferace sliznice orálně od anastomózy po extrakci stentu (snímek MUDr. Martin Lukáš, ISCARE)
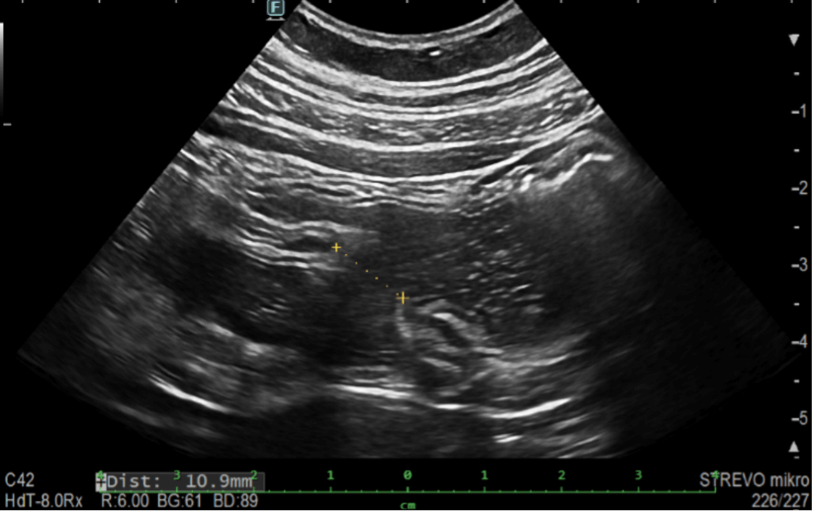
Obrázek 9. IK anastomóza šíře 10,9 mm s procházejícím střevním obsahem bez prestenotické dilatace lumen.
Reference:
- Maaser Ch, Sturm A, Vavricka SR et al. ECCO-ESGAR Guideline for Diagnostic Assessment in IBD Part 1: Initial diagnosis, monitorin of known IBD, detection of complications. Journal of Crohn´s and Colitis, Volume 13, Issue 2, February 2019, Pages 144-164 K.
- Maconi G, Nylund K, Ripolles T et al. EFSUMB Recommendations and Clinical Guidelines for Intestinal Ultrasound (GIUS) in Inflammatory Bowel Diseases. Ultraschall in Med 2018; 39: 304–317.
C-APROM/CZ/ENTY/0169

