MUDr. Tomáš Vaňásek, Ph.D., Hepato-Gastroenterologie HK, s.r.o., Hradec Králové
Anamnéza: Muž, 54 let
Rodinná: otec prodělal tuberkulosu, zemřel na infarkt myokardu v 70 letech, matka žije, nestoná, sestra a dcera zdravé, nestonají
Osobní: běžné dětské nemoci, standardní očkování včetně tuberkulózy, vážněji nestonal do 38 let věku kdy zjištěna ulcerozní kolitida, ve stejné době ledvinové kameny což vyřešeno stentováním močovodu s odchodem kamene, nebyla recidiva. V 48 letech vzestup krevního tlaku a rozvoj osteoporózy a kompresivních fraktur páteře. V 50 letech věku katarakta a zvýšený nitrooční tlak. Po 55 letech věku hypercholesterolemie. Opakovaně zhoršení dermatitidy v souvislosti s léčbou vyššími dávkami kortikosteroidů. Od 30 let věku nekuřák.
IBD: problémy s krvácením z konečníku a nepravidelnými průjmy měl řadu let před stanovením diagnózy ulcerozní kolitidy, koloskopické vyšetření podstoupil v 38 letech věku s endoskopickým i histologickým obrazem ulcerozní kolitidy, pankolitidy.
Farmakologická: do zjištění ulcerozní kolitidy byl nemocný bez pravidelné medikace. Kortikosteroidy v době relapsu podávány v dávce 60-40 mg prednisonu denně, udržovací dávka v rozmezí 10 – 20 mg denně, byl střídán prednisolon a metylprednisolon, dostával preventivně omeprazol; calcium užíval ne zcela pravidelně s vitaminem D. Azathioprin byl v léčbě zaveden a vysazen v 44 letech věku, netoleroval ani následně zkoušený merkaptopurin. Budenosid podáván při snižování kortikoidů, terapeutická odpověď nebyla dostatečná. Léčba alendronatem od 50 let věku dále. Nemocný se zúčastnil klinické studie s golimumabem, nedošlo k navození remise a chybí bližší informace o této léčbě. Biosimilární infliximab byl aplikován v infuzích podle obvyklého schématu po dobu 37 měsíců, došlo k sekundární ztrátě odpovědi. Hypertenze léčena podáváním ACE inhibitorů, osteoporosa podáváním alendronatu per os 1x týdně. Hypercholesterolemie byla upravena léčbou atorvastatinem.
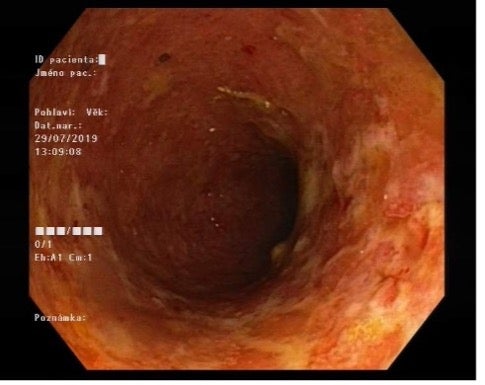
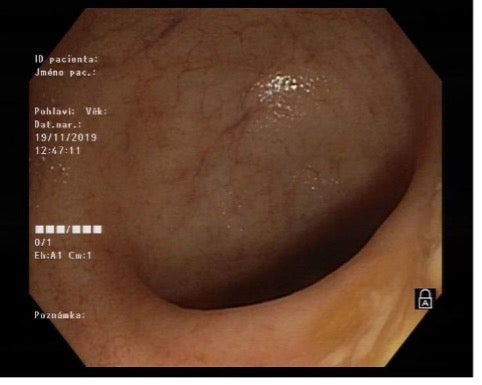
Popis případu: V době zjištění onemocnění v 38 letech věku po několikaletém výskytu nepravidelných potíží byla zahájena léčba kortikosteroidy a mesalazinem, došlo k relativně rychlé klinické odpovědi a při udržovací léčbě mesalazinem byl stav uspokojivý po dobu 6 let. Při relapsu byly nasazeny opět systémové kortikoidy a při postupném snižování dávky byla zahájena léčba azathioprinem. Tu nemocný netoleroval pro těžkou dyspepsii a zvracení. Pro nežádoucí účinky, horečky, vysazen i dále zkoušený merkaptopurin podávaný per os. Klinický stav se zlepšil za cenu dlouhodobé léčby systémovými kortikosteroidy v nízké a střední dávce. Další relaps po necelém roce byl řešen navýšením dávky steroidů. Hladina kalprotektinu byla setrvale zvýšena. Nemocný byl léčen v rámci klinické studie, kde zkoušeným lékem byl golimumab, bez dosažení klinické odpovědi. V 48 letech se objevily bolesti nosného aparátu, při bližším vyšetření s přítomností kompresivních fraktur Th5 a L obratlů. Byla zavedena pravidelná léčba v osteologickém centru, krom navýšení substituce vitaminem D a vápníkem i alendronátem. Postupně stoupal krevní tlak a laboratorně zaznamenána hypercholesterolemie.. Pro subjektivní zhoršení visu diagnostikována počínající katarakta a zvýšený nitrooční tlak. V 49 letech byl referován do centra s možností standardního podání biologické léčby a za standardních kautel zahájeno podávání biosimilárního infliximabu, navozena remise a pomalu redukovány až vysazeny kortikosteroidy. Při dohledové endoskopii v 51 letech snesen adenom s nízkým stupněm dysplazie z v té době nepostižené oblasti vzestupného tračníku, podle endoskopického i histopatologického obrazu je považován za sporadický adenom. Po 3 letech léčby nemocný opět zaznamenával přítomnost růžového hlenu ve stolici a stoupla hladina kalprotektinu ve stolici nad 900 ug/g, i při hladině infliximabu nad 14 ug/ml při negativních protilátkách k léku se subjektivní potíže zhoršovaly a endoskopický nález byl hodnocen jako Mayo skore 3 v oblasti rekta a skore 2 v levém tračníku. Bylo nutno přechodně opět podávat systémové kortikoidy a nemocný byl převeden k léčbě vedolizumabem , po 3. podání 300 mg infuze se výrazně zlepšil klinický stav i endoskopický nález (Mayo skore sigma 0, rektum 1). Po 27 měsících léčby vedolizumabem 300 mg a 8 týdnů v infuzi byl nemocný převeden v době klinické remise na podávání 108 mg s.c. a 14 dní což nemocný dobře zvládá a hladiny vedolizumabu se pohybují od 25 do 40 mg/l. Klinické potíže s s touto léčbou trvající 13 měsíců akceptovatelné s celkovým Mayo skore kolem 5 bodů. Mesalazin je podáván nepřetržitě od vzniku onemocnění a léčba není vysazena. Nemocný nemá zájem o radikální chirurgické řešení a současnou kvalitu života považuje za uspokojivou, osteopatie, hypertenze, oční postižení, dermatitida jsou kontrolovány.
Zobrazovací metody:
Reference relevantní k problematice:
Sands B.e., et al. Vedolizumab versus Adalimumab for Moderate-to-Severe Ulcerative Colitis. September 2019. New England Journal of Medicine 381(13):1215-1226
Buchman A. Side Effects of Corticosteroid Therapy. November 2001. Journal of Clinical Gastroenterology 33(4):289-94
Obrázky: esovitý tračník před a po podání idnukční léčby vedolizumabem
C-APROM/CZ/ENTY/0116

