MUDr. Marta Kostrejová
Interní oddělení NMSKB, Praha
Popis případu:
Pacient nar. v r. 1984 trpěl ulcerózní kolitidou (UC) od roku 2006. Již v době stanovení diagnózy bylo zjištěno postižení celého tlustého střeva. Od počátku léčby dostával maximální dávky mesalazinu (3.6-4.8g/d) a azathioprin 2.0 mg/ kg. Do března 2015 byla choroba plně pod kontrolou při zavedené medikamentózní terapii, pacient neměl prakticky žádné obtíže. Od března 2015 však došlo ke zhoršení stavu, který si vynutil opakované podávání kortikoidů (prednison 40 mg denně). Vždy došlo pouze k přechodnému zlepšení, ale dlouhodobé remise nebylo dosaženo. Proto byla od 3.1. 2016 zahájena biologická léčba golimumabem v indukční dávce 200 mg/100 mg a dále 50 mg a 4 týdny s.c.. Při kontrole dne 23.3.2016 byl nemocný již v klinické remisi a mohl odcestovat služebně do zahraničí. Při kontrole 17.6.2016 udával však opětovné zhoršení, zhubnul 3 kg za měsíce (BMI 18.5), frekvence stolic se pohybovala mezi 7-8 za den; hodnoty laboratorních parametrů byly vysoké (CRP 31,7mg/l; FC 2500 mg/g. V této fázi byla vyloučena bakteriální superinfekce a také infekce Clostridium difficile.
V červnu 2016 byla terapie golimumabem intenzifikována na 100 po 4. týdnech a nemocný současně dostával mesalazin v dávce 3g denně a budesonid 9 mg a přechodně antibiotika (metronidazol a ciprofloxacin). Při kontrole koncem srpna 2016 uváděl zlepšení klinického stavu a v této době znovu služebně odcestoval na 3 měsíce mimo republiku (pracovní pobyt v Německu a ve Spojeném Království). Po návratu koncem října 2016 se necítil dobře, zhubnul další 3 kg, udával do 5 stolic s ojedinělou příměsí krve.
Při kontrolní koloskopii v listopadu 2016 byla potvrzena pankolitida, v pravé polovině tračníku středně těžké zánětlivé aktivity (Mayo 2), v sigmatu a v rektální ampule byly přítomny vředy (Mayo 3). Cytomegalovirová infekce a infekce Clostridum difficile nebyly průkazné. Hodnota FC byla velmi vysoká (FC > 2540 ug/g). Hospitalizaci z pracovních důvodů odložil o 1 týden. 27.11.2016 bylo zjištěno významné zhoršení celkového stavu a to při při interkurentní infekcí horních cest dýchacích. Pacient měl několik dnů trvající vlhký kašel, horečky 38-39stC, které byly doprovázené zimnicí, dušností a intermitentními bolestmi na hrudníku. Nápadné bylo tmavé zbarvené moče, které před tím nikdy nepozoroval. Na vyšetření se dostavil 1.12.2016, kdy byl febrilní, tachypnoický a ikterický, hypotenzní (TK: 90/60 mmHg) a tachykardický (P: 122 reg). V klinickém obraze dominovala dušnost a tachypnoe (dechová frekvence 32/min) a hyposaturace (pO2 84.5%). V celkově těžkém stavu byl přijat na JIP naší nemocnice. Příčinou rozvíjejícího se šokového stavu byla masívní plicní embolie s těžkou plicní hypertenzí (P 85mm/Hg) a hemolytická anemie (bilirubin 84,5umol/l, Leu: 33 109 /l, Hb 77g/l) s pozitivním Coombsovým testem. 2.12.2016 provedena úspěšná systémová trombolýza. Příčinou masivní embolie do plicnice, jak se později ukázalo, byla hereditární trombofilie aktivátorů plasminogenu a vysoká zánětlivá aktivita UC. Hematologem po vyloučení lymfoproliferativního onemocnění byla potvrzena autoimunní hemolytická anemie s pozitivními tepelnými protilátkami typu IgG (3+), proti erytrocytům u vysoce aktivní UC.
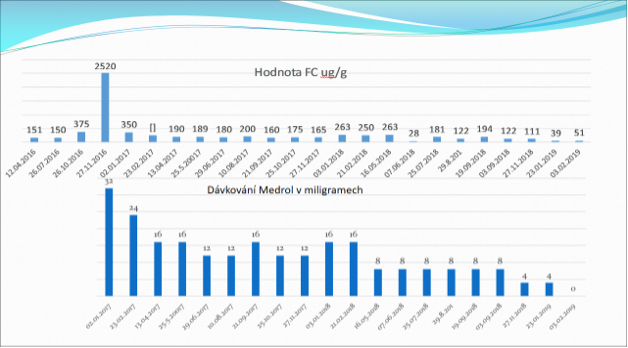
Od 18.1.2017 zahájená léčba infliximabem v dávce 5 mg/kg hmotnosti, současně pokračující léčba prednisonu 20mg/den, současně s nízkomolekulárním heparinem. V dubnu 2017 pro nízké koncentrace infliximabu (IFX) byla provedena intenzifikace dávky na 10 mg/ kg, přesto byla kontrolní hladina ( po půl roce)téměř nulová, protilátky proti IFX lehce pozitivní. Současně se objevily bolesti kloubů, proto byla léčba IFX ukončena. V lednu 2018 byla zahájena léčba vedolizumabem i.v. v klasickém indukčním režimu 0-2-6 týdnů, od 20. týdne léčby pro neuspokojivý výsledek byl pacient převeden na intenzifikovaný terapeutický režim s aplikací vedolizumabu i.v. po 4 týdnech. Současně mohla být redukována denní dávka metylprednisolonu na 16 mg denně, po měsíci se dávka začala snižovat cca o 4 mg za 2-3 týdny. Dne 3.2.2019 byla léčba kortikoidy ukončena úplně (viz graf č.1). Koncentrace CRP se pohybovala v normálních rozmezích, rovněž hodnoty červeného krevního obraz a fekálního kalprotektinu byly ve fyziologických mezích. Koloskopie provedená v dubnu 2019 jeden rok po zavedení terapie vedolizumabem vykazovala kompletní zhojení zánětu. V červnu 2019 byla pro chronickou tromboembolickou plicní hypertensi (NYHA III) s těžkou prekapilární hypertenzí provedena endarterektomie plicních tepen v mimotělním oběhu a zahájena celoživotní antikoagulační léčba.
Nemocný je od té doby bez obtíží a setrvává v dlouhodobé hluboké remisi.
Závěr:
Popsán případ aktivní UC, která byla komplikována vznikem autoimunní hemolytické anemií s tvorbou tepelných protilátek proti erytrocytům při do té doby asymptomatické hereditární trombofilií plasminogenu 1 (PAI-1). Důsledkem trombofilie byla masivní plicní embolie a následný rozvoj chronickou trombo-embolické choroby (NYHA III). Vedolizumab i.v. v intenzifikovaném režimu vedl k navození kompletní remise UC. Pro těžkou plicní hypertenzi byla provedena end-arterektomie plicních tepen.
Obrazová dokumentace:
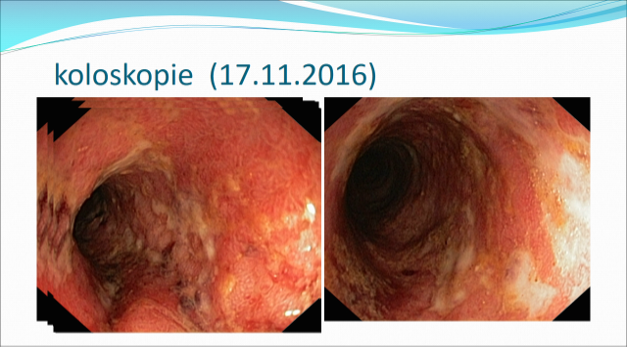
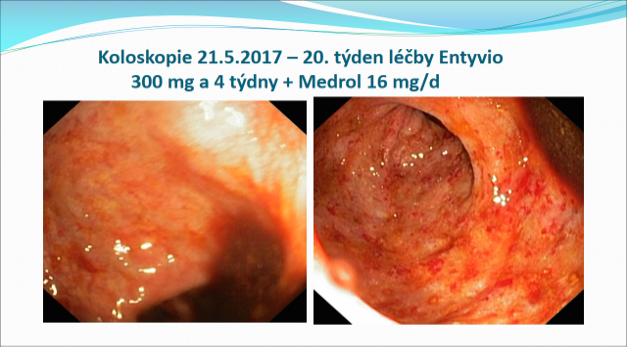
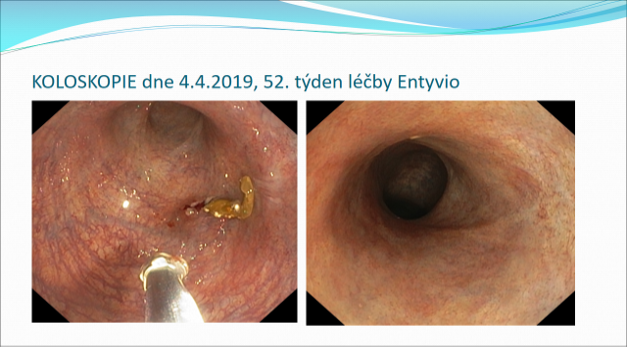
Koloskopie 17.11.2016: Vysoce aktivní UC s kyprou, krvácející sliznicí a povrchovými vředy. 2. Kontrolní vyšetření v týdnu 26 vykazuje mírné zlepšení nálezu. 3. Hluboká remise v týdnu 52, nález ukazuje kompletní zhojení zánětlivých změn.
Graf: Léčba kortikosteroidy v průběhu let 2017-2018.
Komentář:
- Extraintestinální manifestace se vyskytují u pacientů s UC s četností 25–40% a platí, že počet případů narůstá s délkou trvání choroby a postihuje většinu orgánových soustav
- Závažnou, poměrné vzácnou mimostřevní komplikací v průběhu vysoce aktivní UC, je vznik autoimunní hemolytické anemie (AIHA). Její začátek může být spojen s interkurentní infekcí nebo relapsem ulcerózní kolitidy. Kombinace autoimunní hemolytické anémie (AIHA) a IBD je udávána od 0,2–1,7 %.
- AIHA u UC je zprostředkovaná tepelnými autoprotilátkami typu IgG1, které jsou namířené proti některému z membránových antigenů erytrocytu, což vede k intravaskulární hemolýze aktivací komplementu, či k zániku erytrocytů s navázanou protilátkou v monocyto-makrofágovém systému sleziny
- Základním diagnostickým testem u AIHA je přímý a nepřímý Coombsův antiglobulinový test (PAT) AIHA se projeví hlubokou makrocytovou anemií a retikulocytózou
- Ve většině případů měli nemocní v době diagnózy AIHA akutní IBD. K úspěšné léčbě AIHA je důležité dosažení kompletní remise UC.
- V léčbě AIHA s tepelnými protilátkami se v 1. linii stále uplatňuje podávání kortikosteroidů v dávce 1.0-1,2 mg/kg i na několik měsíců
- U většiny případů aktivní UC v kombinaci s AIHA se osvědčila imunosupresivní léčba cyklofosfamidem v dávce 1,5-2 mg/kg/den nebo azathioprin v dávce 1,5-2 mg /den, léčba biologickými preparáty (anti- TNFalfa, anti- integrinová protilátka IgG1)
- Trombo-embolické komplikace jsou druhou vedoucí příčinou úmrtí pacientů s UC. Predisponujícímu faktory je vysoká aktivita střevního zánětu, imobilizace pacientů, podávání kortikosteroidů a vrozený, do té doby nerozpoznaný, primární hyperkoagulační stav.
Literatura:
- Forcione DG, Frieman LS. Extraintestinal manifestations of Inflammatory bowel disease. In: Lichtenstein GR. The clinician´s guide to inflammatory bowel disease. Slak Thorofare 2003: 76–112.
- Sharma SC, Tonk RS, Gadpayale AK Autoimmune Haemolytic Anaemia associated with Ulcerative Colitis , JIACM 2002; 3(2): 198-201
- Martins D, Ministro P, Silva A. Refractory Chronic Pouchitis and Autoimmune Hemolytic Anemia Successfully Treated with Vedolizumab Port Journal Gastroenterology 2018 Nov; 25(6): 340–341
- Tomoya Iida, Shuji Satoh, Suguru Nakagaki Autoimmune Hemolytic Anemia Triggered by Infection with Human Parvovirus B19 after Total Abdominal Colectomy for Ulcerative Colitis, Intern Med. 2016;55(6):677-81
- Molnár T, Farkas K, Szepes Z Autoimmune hemolytic anemia associated with ulcerative colitis: the most important step is to induce complete remission, Am.Jour. Gastroenterol 2010 May;105(5):1203-4; author reply 1204
C-APROM/CZ/ENTY/0116

