Jméno lékaře, pracoviště:
MUDr. Milan Široký, interní oddělení Pardubická nemocnice, Nemocnice Pardubického Kraje
Anamnéza: zdravá pacientka, nekuřačka, bez známých alergií a s negativní rodinou anamnézou
Farmakologická: 0
Popis případu:
26 letá, jinak zdravá pacientka, nekuřačka, léčena pro ulcerózní kolitidu diagnostikovanou v březnu 2016. Rozsahem pankolitis, Mayo 2. Léčena v úvodu standardně mesalazinem v dávce 4g p.o. s nutností opakovaného podávání kortikosteroidů (celkem 3x během jednoho roku) při nesnášenlivosti azathioprinu, který nemohl být podáván z důvodu GIT intolerance. V květnu 2017 byla pacientce nabídnuta studijní léčba etrolizumabem (humanizovaná IgG1 protilátka, která se selektivně váže na podjednotku β7 integrinových receptorů α4β7 a αEβ7), na které stav stabilní s endoskopickou remisí až do ukončení studie v květnu 2022. V lednu 2023 dochází k relapsu ulcerózní kolitidy, opět nasazeny kortikoidy. Léčba byla pro palpitace jako nežádoucí účinek kortikosteroidní terapie ukončena předčasně. Po vyloučení superinfekcí proto zahájena léčba infliximabem i.v., dochází ale v druhém týdnu při podání infliximabu k akutní alergické reakci, infuze byla zastavena a další podávání infliximabu je tedy kontraindikováno. Při rozmýšlení o druholiniové nestudijní terapie jsme se rozhodli, i vzhledem k přihlédnutí k velmi dobré toleranci a efektu antiintegrinové léčby, k podávání léku opět z této kategorie. Vzhledem k výše uvedenému zahájena terapie vedolizumabem (monoklonální protilátka cílená na α4β7 integrin) v dávkování 300mg i.v. 0.,2.a 6.týden a dále á 8 týdnů. Stejně tak jako první antiintegrinová protilátka i vedolizumab je u pacientky s velmi dobrým efektem a tolerancí. Pacientka je nyní bez kortikoidů, v remisi jak klinické, tak endoskopické a histologické. Vedolizumab je monoklonální protilátka cílená na α4β7 integrin, která selektivně brání migraci lymfocytů do střevní submukózy a tím brání zánětu v trávicí trubici. Předpokládaný podobně dobrý účinek jako v počátcích léčby se u pacientky potvrdil i v reálné praxi. Přidanou výhodou vedolizumabu je příznivý bezpečnostní profil léčiva a je tedy vhodný k dlouhodobé terapii.
Obrázky:
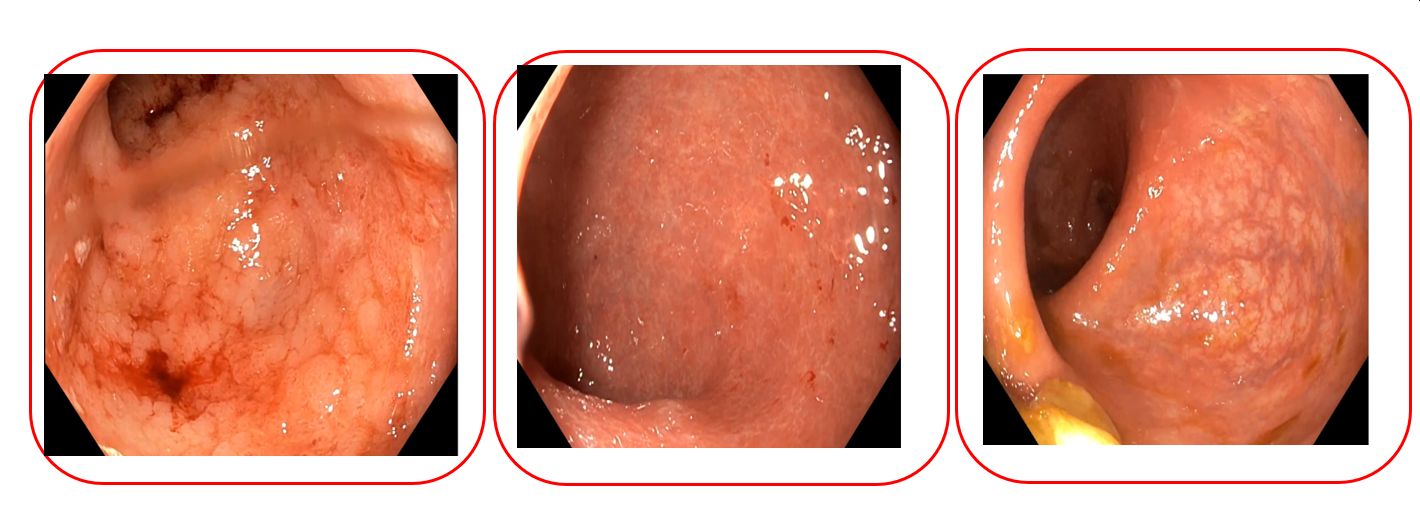
Reference:
Bortlík M, et al. Doporučení pro podávání biologické terapie u idiopatických střevních zánětů: třetí, aktualizované vydání Gastroent Hepatol 2016
Soler D, et al. The binding specifi city and selective antagonism of vedolizumab, an anti-alpha4beta7 integrin therapeutic antibody in development for infl ammatory bowel diseases. J Pharmacol Exp Ther 2009; 330(3)
Douda T, Pokroky v terapii idiopatických střevních zánětů, Interní Med. 2017; 19(3): 110–115
Vermeire S, O‘Byrne S, Keir M, et al. Etrolizumab as induction therapy for ulcerative colitis: a randomised, controlled, phase 2 trial. Lancet 2014; 384: 309–318.
Datum přípravy: 12/2024, C-APROM/CZ/ENTUC/0017

