Jméno lékaře, pracoviště: MUDr. Nováková Karolína, II. interní klinika FNOL
Anamnéza: Maligní melanom kůže krku vpravo, radikální excize 2000, bloková disekce krčních uzlin vpravo 2001 - bez metastatického postižení uzlin, adjuvantní imunoterapie do 2003, recidiva 2013 - bloková disekce s parotidektomií vpravo, provedena i levostranná parotidektomie + resekce glandula submandibularis, lupénka v mládí
IBD M. Crohn, dg. 7/2023
Farmakologická stran IBD žádná
Popis případu: Pacient odeslán na naší kliniku ke konci června 2023 k došetření nálezu na CT z onkologie, kde dispenzarizován pro metastatický maligní melanom kůže. Pacient na kontrole u onkologa uvádí postupné zhoršování chronických trávicích obtíží, především křeče břicha se studeným potem a pocity nafouknutí, které má několikrát do měsíce. Na CT břicha popsáno pravděpodobně zánětlivé postižení jejuna vč. stenóz a prestenotických dilatací. V době prvního vyšetření na naší klinice pomalu ale jistě hubne a nadále se zhoršuje stav až do obrazu pasážových obtíží, bez zvracení.
Na indikované enteroskopii je nález zánětlivých změn od D2 duodena, od duodenojejunálního přechodu vizualizovány 3 stenózy s ulceracemi, aborální stenóza neprůchodná pro enteroskop. Již makroskopicky je vysloveno podezření na Crohnovu chorobu, diagnóza biopticky potvrzena.
Pacient vzhledem k lokalizaci zánětlivých změn a tíži obtíží indikován neprodleně k zahájení biologické léčby, pro anamnézu metastatického maligního melanomu a věk 50+ zvolen v první linii vedolizumab. První podání probíhá do měsíce od diagnostické enteroskopie, v červenci 2023. Na konci prázdnin je pacient konzultován na mezioborovém IBD boardu s chirurgy a vzhledem k rozvíjejícím se pasážovým obtížím je rozhodnuto o resekci postižených stenotických úseků jejuna.
V září 2023 pacient přichází na kontrolu při podání poslední indukční dávky vedolizumabu. Uvádí “zlepšení trávicích obtíží o 100%” a odmítá chirurgickou léčbu. Pasážové obtíže v průběhu podzimu 2023 zcela ustupují, pacient nabírá na svou původní váhu a vrací se do zaměstnání. Kalprotektin klesá z původních 3128 na hodnoty okolo 1000. Pro obtížně zajistitelný periferní žilní vstup od listopadu 2023 převeden na vedolizumab 108 mg s.c. á 2 týdny.
Na jaře 2024 provedena kontrolní vyšetření - MR enteroklýza, kde je nález stacionární stran stenóz, ale nejsou známky aktivního zánětu v postkontrastní fázi vyšetření, čemuž odpovídá i nález na gastroskopii, který je do D3 duodena negativní a to včetně bioptického ověření. Kontrolní enteroskopie pro dobrý klinický stav zatím indikována nebyla.
Zobrazovací metody:
Obrázky:
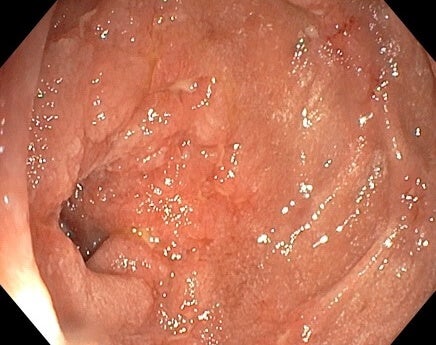
Stenotický úsek jejuna, enteroskopie 7/2023
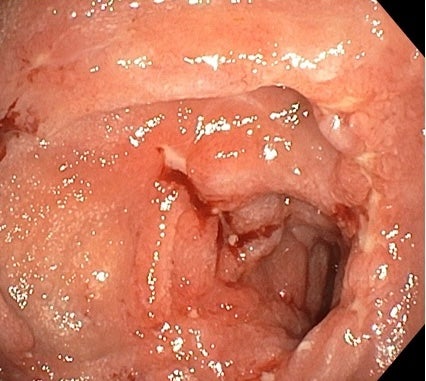
Mnohočetné ulcerace duodena, enteroskopie 7/2023
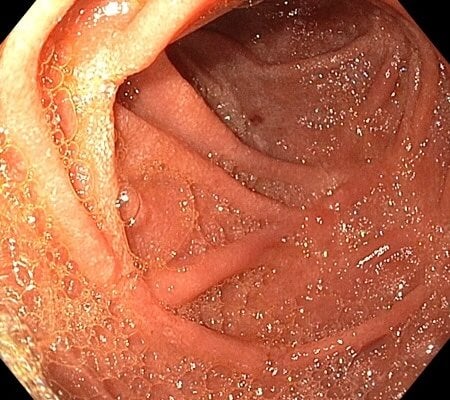
Vyhojené slizniční změny v duodenu - gastroskopie 2/2024
Datum přípravy: 06/2024 // C-APROM/CZ/ENTCD/0003

