“Vedolizumab is a monoclonal antibody to the α4β7 integrin that selectively reduces intestinal lymphocyte trafficking, thereby providing a safe and effective treatment option for patients with inflammatory bowel disease (IBD).” 1
Za normálních okolností se na na některých naivních T a B lymfocytech (vč. bb přirozeného imun.systému), exprimuje epitop α4β7 ( transmembranózní adhezivní protein). Jeho ligandou je adhezivní molekula MAdCAM-1 (mucosal vascular addressin cell adhesion molecule 1), která se primárně objevuje na endoteliálních buňkách v GIT a GIT- asociovaných lymfatických tkáních. Díky jejich spojení dochází ke zpomalení valivého pohybu lymfocytů, až k možnosti průchodu do lamina propria.
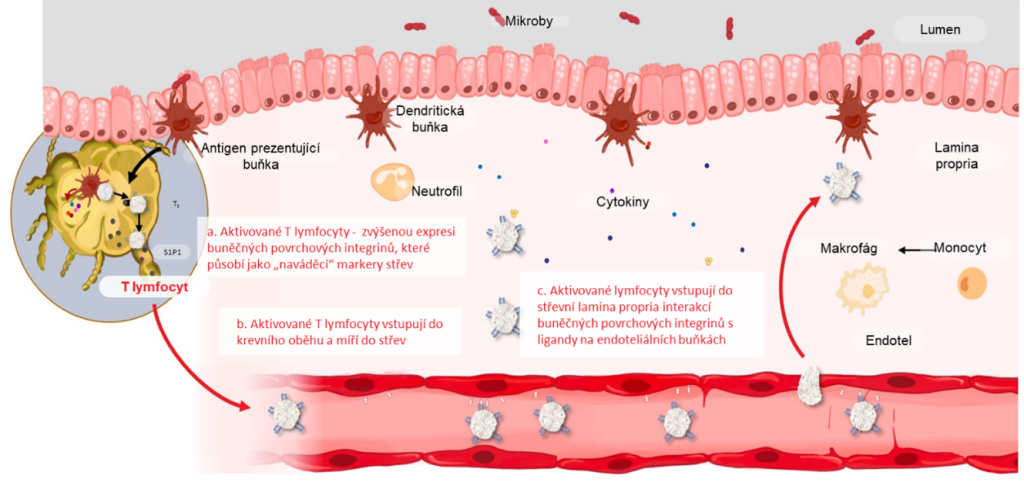
Převzato a upraveno dle: Coskun M, et al. Trends Pharmacol Sci. 2017. Neurath M. Nat Immunol. 2019.
Při vzniku IBD hraje významnou roli diskrepance mezi prozánětlivými a protizánětlivými mechanizmy, dochází k výrazné migraci lymfocytů do stěny střeva a k prohlubování zánětu.
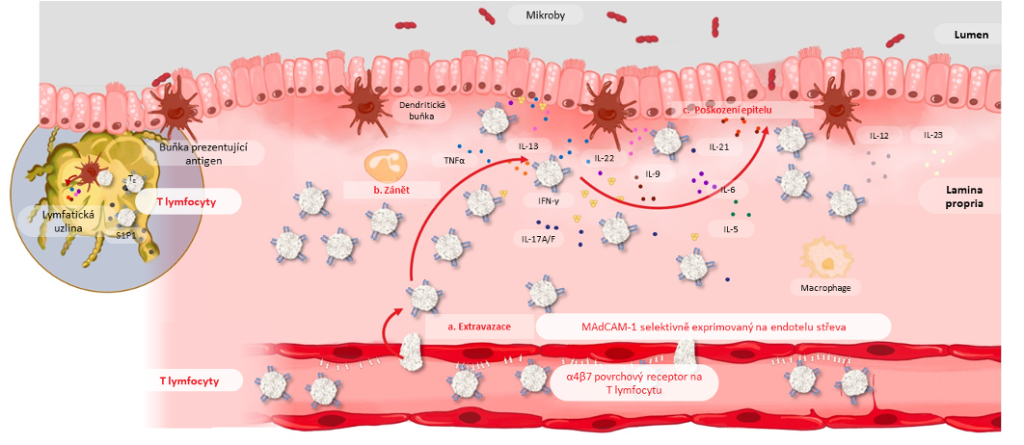
Převzato a upraveno dle: Coskun M, et al. Trends Pharmacol Sci. 2017;38:127–42 a Neurath M. Nat Immunol. 2019;20:970–79.
Vedolizumab je humanizovaná monoklonální protilátkatypu IgG1, patřící do skupiny anti-integrinové terapie. Je schopna se navázat na epitop α4β7, tím zabránit vazbě s Mad-CAM-1 a snížit množství lymfocytů migrujících do stěny střeva. Jeho účinek je selektivní. Má velmi příznivý bezpečnostní profil.2
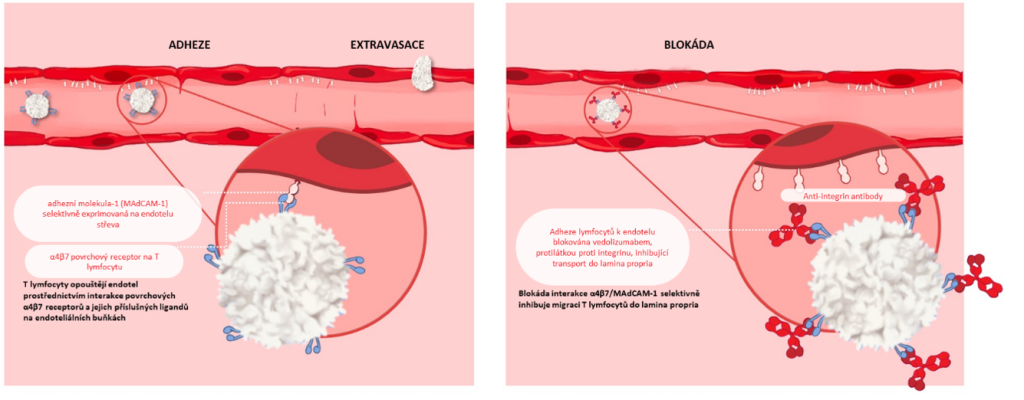
Soler D et al. J Pharmacol Exp Ther 2009. 2. Haanstra KG, et al. J Immunol. 2013;Zundler S, Becker E, Schulze LL, et al. Gut. 2019.
Vedolizumab je indikován k léčbě dospělých pacientů se středně těžkou až těžkou aktivní ulcerózní kolitidou, u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují. Přípravek Entyvio je indikován k léčbě dospělých pacientů se středně těžkou až těžkou aktivní Crohnovou chorobou, u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují. Přípravek Entyvio je indikován k léčbě dospělých pacientů se středně těžkou až těžkou aktivní chronickou pouchitidou, kteří podstoupili proktokolektomii s ileopouch-anální anastomózou v rámci léčby ulcerózní kolitidy a mají nedostatečnou odpověď na antibiotickou léčbu nebo na ni přestali odpovídat.
K dispozici je vedolizumab 300mg- určený k intravenozní aplikaci (i.v.), a vedolizumab 108 mg- určený k subkutánnímu podání (s.c.). Doporučený režim dávkování 300mg vedolizumabu je i.v. infuze v týdnu 0, 2 a 6, a dále pak každých 8 týdnů. Pacienti s Crohnovou chorobou, u nichž nedošlo k odpovědi na léčbu, mohou mít prospěch z dávky intravenózního vedolizumabu v týdnu 10. Doporučený režim dávkování subkutánně podávaného vedolizumabu jako udržovací léčby po alespoň 2 intravenózních infuzích je 108 mg podávaných subkutánní injekcí každé 2 týdny. První subkutánní dávka se musí podat místo příští plánované intravenózní dávky a poté každé 2 týdny.3
Reference:
- Battat- R. st al., HUMAN VACCINES & IMMUNOTHERAPEUTICS PRODUCT REVIEW
A product review of vedolizumab in inflammatory bowel disease 2019, VOL. 15, NO. 10, 2482–2490 - Colombel J-F, et al. Gut 2017;66:839-851
- SPC Entyvio
Datum přípravy: září 2023
C-APROM/CZ/ENTY/0186

