Jméno lékaře, pracoviště: MUDr. Pavel Svoboda, Ph.D.
Oddělení gastroenterologie, hepatologie a pankreatologie
Interní a kardiologická klinika Fakultní nemocnice Ostrava
Lékařská fakulta Ostravské Univerzity
Anamnéza celková:
Karcinom prsu po segmentektomii s exenterací axily vlevo T1N0M0 s následnou radioterapií 2007, léčba tamoxifenem do 2012, bez známek progrese onemocnění
ICHS chron., NYHA II, SKG 4/2017 s nástěnnými aterosklerotickými pláty ke konzervativnímu postupu
Ess. hypertenze II. stadia dle WHO
Hypothyreosa na substituci
Divertikulóza sigmoidea
Vnitřní hemorhoidy
Anamnéza IBD:
Ulcerózní kolitida v rozsahu pankolitidy s Mayo endoskopickým skóre (dále jen MES) 3, diagnostikována v 11/2017
Anamnéza farmakologická:
6/2020 mesalazin, budesonid, antihypertenziva, kys.acetylsalicylova, hypolipidemika, L-tyroxin
9/2020 budesonid vyměněn za methylprednisolon16 mg tbl 2-1-0, který následně postupně snižován do 12/2020, kdy vysazen, jinak terapie beze změn
10/2020 vedolizumab 300 mg i.v. v indukčním režimu 0., 2. a 6. týden, poté co 8 týdnů
10/2021 vedolizumab 300 mg i.v. intenzifikováno na podávání co 4 týdny
Popis případu:
Pacientka narozená v roce 1947, s anamnézou karcinomu prsu, hypertenze a ICHS, měla zjištěnou těžkou ulcerózní kolitidu v rozsahu pankolitidy v listopadu 2017 soukromým gastroenterologem, kterým byla léčena mesalazinem a intermitentně i budesonidem. Začátkem roku 2020 měla relaps ulcerózní kolitidy, fekální kalprotektin (dále jen FK) byl tehdy 2168, opět zaléčena budesonidem a v červnu 2020 byla odeslána na naše pracoviště ke zvážení další terapie.
Při vstupním vyšetření zmiňovala až 10 řídkých stolic za den, některé s příměsí krve, bolesti, teploty a váhový pokles negovala. Poslední zhoršení klinického stavu dávala do souvislosti se svévolným vysazením budesonidu. Prvním krokem bylo jeho navrácení do terapie a byl proveden odběr krve a stolice k vyloučení střevní infekce. Za měsíc při kontrole hodnotila efekt terapie kladně, FK byl 1132, krevní odběry zcela v normě, střevní infekce nebyla prokázána.
V září 2020 však došlo opět ke klinickému zhoršení se vzestupem FK nad 1800, koloskopicky byla aktivní ulcerózní kolitida po hepatální flexuru s MES 3, CMV bylo negativní. Budesonid vyměněn za systémové glukokortikoidy v indukční dávce 1mg/kg/den s postupným snižováním. Systémové glukokortikoidy byly v úvodu s výborným terapeutickým efektem, ale při jejich detrakci se opět klinický stav zhoršil. Vzhledem ke kortikodependentnímu průběhu relapsu ulcerózní kolitidy a výše uvedené anamnéze jsme se rozhodli k léčbě vedolizumabem 300mg i.v. ve zvyklém režimu.
Indukční léčba VDZ navodila klinickou remisi a dovolila vysazení systémových glukokortikoidů. I v následujícím období pacientka setrvávala v klinické remisi, FK klesl při kontrolách na hodnoty 607 až 462.
V říjnu 2021 však došlo k dalšímu relapsu, koloskopicky byl přítomný levostranný tvar s MES 2, CMV opět negativní, FK znovu nad 1800, proto byl VDZ intenzifikován na podávání 300 mg i.v. co 4 týdny.
Při kontrole v lednu 2022 udává 4 formované stolice denně, krev přítomná jen sporadicky, FK klesl na 634.
Poslední kontrola se uskutečnila v květnu 2022, pacientka setrvávala v klinické remisi, FK s dalším poklesem na 390, pokračuje léčba VDZ 300 mg i.v. co 4 týdny a mesalazin 800 mg tbl 3-0-0.
Komentář:
Je prezentován případ pacientky s výskytem těžké ulcerózní kolitidy v rozsahu pankolitidy v seniorském věku, s kortikodependentním relapsem v průběhu její léčby a s anamnézou malignity v předchorobí.
Výskyt ulcerózní kolitidy vykazuje dva vrcholy – prvním je období mezi 30. a 40. rokem věku a druhým pak období mezi 60. a 70. rokem života.
Kortikodependence je definována jako nemožnost snížit dávku systémových glukokortikoidů během 3 měsíců pod 10 mg prednisonu/den aniž by došlo ke klinickému zhoršení nebo jako relaps do 3 měsíců od jejich vysazení.
Jednou z indikací k nasazení azathioprinu je právě kortikodependence. Jeho podávání ve vyšším věku však není vhodné pro riziko nárůstu malignit a infekčních komplikací.
Historicky prvními biologickými léky k léčbě idiopatických střevních zánětů jsou inhibitory TNF alfa, ale i jejich podávání ve vyšším věku je spojeno s vyšším výskytem komplikací, zejména infekčních.
Pacienti s anamnézou malignity v předchorobí mají vždy zvýšené riziko recidivy původní malignity anebo vzniku malignity de novo. Z tohoto důvodu není vhodné u nich zahajovat dlouhodobou léčbu azathioprinem či anti-TNF alfa.
Vedolizumab byl schválen k léčbě ulcerózní kolitidy v roce 2014. S ohledem na jeho selektivní působení v trávicí trubici se zdá být z hlediska bezpečnosti optimálním biologickým preparátem u pacientů s maligním onemocněním mimo střevní trakt. Ze stejného důvodu vykazuje i velmi příznivý bezpečnostní profil stran rizika infekčních komplikací. Jeho účinnost i bezpečnost v léčbě ulcerózní kolitidy byla ověřena klinickou studií GEMINI I. Studie EVOLVE hodnotila efekt vedolizumabu u bionaivních pacientů se závěrem, že je srovnatelně účinný v porovnání s anti-TNF, navíc po prvním roce léčby vykazoval větší perzistenci léčby a méně nežádoucích účinků. Ve světle těchto okolností jsme se rozhodli pro podání Entyvia v první linii biologické léčby, což indikační omezení SÚKLu umožňují. Trvající klinická remise a nekomplikovaný průběh léčby potvrzují správnou volbu terapie.
Obrázky:
Ulcerózní kolitida s MES 3 při koloskopii 9/2020.
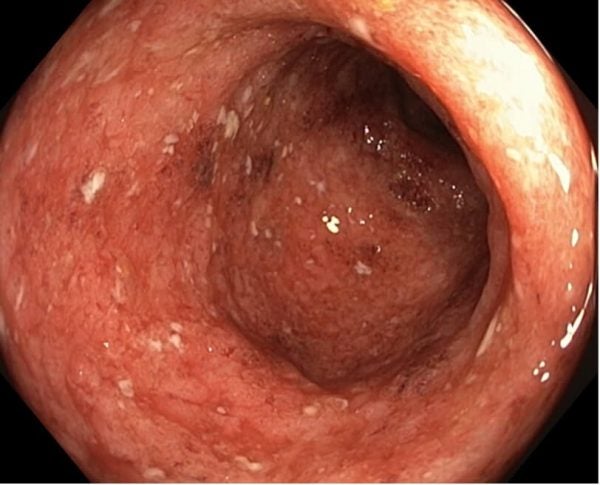
Zdroj fotografií: databáze autora
Reference:
Doporučení Pracovní skupiny pro idiopatické střevní záněty pro diagnostiku a medikamentózní léčbu ulcerózní kolitidy, Gastroent Hepatol 2022; 76(1), 13-28
https://www.sukl.cz/modules/medication/detail.php?code=0210049&tab=prices
SPC Entyvio 300 mg
Datum přípravy: červen 2022
C-APROM/CZ/ENTY/0082
ENTYVIO
Zkrácené informace o přípravku:
Název: Entyvio 300 mg prášek pro koncentrát pro infuzní roztok (i.v.). Entyvio 108 mg injekční roztok v předplněném peru (s.c.). Složení: Entyvio 300 mg: Jedna injekční lahvička obsahuje vedolizumabum 300 mg. Po rekonstituci jeden ml obsahuje vedolizumabum 60 mg. Seznam pomocných látek viz SPC. Entyvio 108 mg: Jedno předplněné pero obsahuje vedolizumabum 108 mg v 0,68 ml. Seznam pomocných látek viz SPC. Indikace: Entyvio i.v. + s.c. Léčba dospělých pacientů se středně těžkou až těžkou aktivní ulcerózní kolitidou (UC) nebo se středně těžkou až těžkou aktivní Crohnovou chorobou (CD), u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují. Entyvio i.v.: indikován k léčbě dospělých pacientů se středně těžkou až těžkou aktivní chronickou pouchitidou, kteří podstoupili proktokolektomii s ileopouch-anální anastomózou v rámci léčby ulcerózní kolitidy a mají nedostatečnou odpověď na antibiotickou léčbu nebo na ni přestali odpovídat. Dávkování a způsob podání: Entyvio 300 mg: Doporučená dávka je 300 mg podávaných i.v. infuzí v týdnu 0, 2 a 6, a dále pak každých 8 týdnů (viz SPC); Entyvio 108 mg: Subkutánně podávaný vedolizumab (108 mg) je určen pro udržovací léčbu podávanou po alespoň 2 intravenózních infuzích, každé 2 týdny (viz SPC). Bezpečnost a účinnost vedolizumabu u dětí ve věku od 0 do 17 let nebyla dosud stanovena. U starších pacientů se úprava dávkování nevyžaduje. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Aktivní závažné infekce, jako jsou tuberkulóza, sepse, cytomegalovirus, listerióza, a oportunní infekce, jako je progresivní multifokální leukoencefalopatie (PML). Zvláštní upozornění: U pacientů, kterým byl podáván vedolizumab, byly hlášeny reakce související s infuzí (IRR) nebo reakce v místě aplikace a hypersenzitivní reakce. Existuje potenciální zvýšené riziko oportunních infekcí nebo infekcí, pro něž je střevo ochrannou bariérou. Před zahájením léčby musí být pacienti vyšetřeni na tuberkulózu. Souběžné používání přípravku s biologickými imunosupresivy se nedoporučuje. Při léčbě se může pokračovat v očkování neživými vakcínami. Entyvio 300 mg: Všechny pacienty je třeba nepřetržitě sledovat během každé infuze a dále přibližně 1 hodinu (u prvních 2 infuzí 2 hodiny) po ukončení infuze. Lékové interakce: Společné podávání kortikosteroidů, imunomodulátorů a aminosalicylátů nemá klinicky významný účinek na farmakokinetiku vedolizumabu. Živé vakcíny, zejména perorální živé vakcíny, je nutno s vedolizumabem používat s opatrností. Nežádoucí účinky: Nejčastěji hlášenými nežádoucími účinky jsou infekce (jako jsou nazofaryngitida, infekce horních cest dýchacích, bronchitida, chřipka a sinusitida), bolest hlavy, nauzea, pyrexie, únava, kašel, artralgie. Byly také hlášeny reakce v místě injekce nebo v místě aplikace. Ostatní viz SPC. Zvláštní požadavky na podmínky uchovávání: Entyvio 300 mg:Injekční lahvičku nutno chránit před světlem, uchovávejte v chladničce (2 °C - 8 °C) Entyvio 108 mg: Nutno chránit před světlem, Uchovávejte v chladničce (2 °C - 8 °C) Chraňte před mrazem. Předplněné pero je možno ponechat mimo chladničku v původní krabičce při pokojové teplotě (až do 25 °C) po dobu až 7 dnů. Držitel rozhodnutí o registraci: Takeda Pharma A/S, Delta Park 45, 2665 Vallensbaek Strand, Dánsko. Registrační číslo: EU/1/14/923/001,005-007. Datum poslední revize: Entyvio s.c. – 3/2024. Datum poslední revize Entyvio i.v. – 3/2024
Přípravek Entyvio 300 mg je v indikaci CD a UC hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Přípravek Entyvio 108 mg je hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Před předepsáním se seznamte s úplným zněním Souhrnů údajů o přípravcích.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na SÚKL nebo společnosti Takeda emailem na AE.CZE@takeda.com

