Autor článku: MUDr. Karel Mareš, Nemocnice Na Homolce
Anamnéza celková:
– lehká hypochromní anémie
– pro dlouhodobé středně intenzivní bolesti malých kloubů rukou byla 11/16 vyšetřena v revmatologickém ústavu: – bez průkazu zánětlivého revmat. onemocnění, HLA B27 negat, bez průkazu sakroileitidy, artróza MTP bilat, calcar calcanei duplex dx, plantaris sin
– 10/19 plicní embolie
– 10/20 kontrola v Revmatologickém ústavu -nadále bez zánětlivého revmatického onemocnění resp. spondylartritidy, resp. jiné chronické polyartralgie u pac.s Crohnovou chorobou -bez průkazu zánětlivého revmatického onemocnění, osteoporóza.
Anamnéza IBD:
1997 původně hodnoceno jako těžká ulcerózní kolitida
1996 incise periproktálního abscesu (tehdy hodnoceno jako gynekologická etologie), po
azathioprinu útlum v bílé řadě
2000 výrazně zlepšena, vysazena kortikoterapie.
2004 relaps choroby, přehodnoceno na CD
– těžká Crohnova choroba (BCH, perianálně a tračníku se stenózou v dist. sigmatu a
některých kliček aborálního ilea)
– primární nonrespondér na adalimumab,
– infliximab – výrazné zlepšení
2012 opakované relapsy (i přes dávkování dle trough levels-nekompletní hojení, s přetrvávající
mírnou aktivitou, postupné zhoršování
2015 sekundární nonrespondér na INF, drenáž periproktální píštěle
2016 vedolizumab – na něm byla klinicky i endoskopicky prakticky v remisi, periproktální píštěl
jen s občasnou minimálnní sekrecí
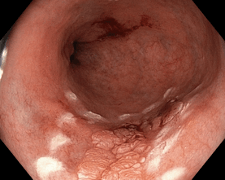
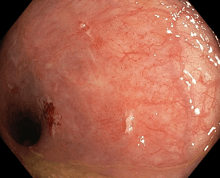
02/17 EPE plošného tubulárního adenomu rekta
02/19 plošný tubulární adenom orálního sigmatu, nešel endoskopicky odstranit
10/19 provedena subtotální kolektomie a resekce 1m tenkého střeva a terminální ileostomie.
2020 po domluvě s pojišťovnou VDZ ponechán, periproktální píštěl v klidu, opakovaně normální endoskopický nález v pahýlu rekta, normální endoskopický nález do 50 cm neoterminálního ilea (dále, pro fixaci střeva srůstem, nikdy neproniknuto),
2020 a 2021- 3x subileozní stav (dietní chyby-vláknina) i s nutností hospitalizace. Jinak byla zcela bez gastrointestinálních potíží. Vzhledem k subileózním stavům a jinak výborné kondici bylo na 04/21 domluveno rozrušení srůstů a proktektomie.
Popis případu:
Pacientka (1963) se od roku 1997 léčí s kolitidou crohnovského typu a následně i s periproktální píštělí. Pro útlum v bílé řadě po azathioprinu byla z počátku léčena kortikoidy. Mezi lety 2000 a 2004 se mohla terapie vysadit. Po relapsu 2004 byla krátce léčena adalimumabem a protože k ní byla primárním nonrespondérem, byl nasazen infliximab. Z počátku měl výborný efekt, ale po cca deseti letech se zvětšila frekvence relapsů a i přes intenzifikovaný režim nebylo hojení kompletní. Pacientka jinou léčbu odmítala. Koncem roku 2015 se stala sekundárním nonrespondérem k INF a 2016 byla převedena na vedolizumab. Na něm byla klinicky i endoskopicky prakticky v remisi, periproktální píštěl byla jen s občasnou minimálnní sekrecí. Vzhledem k délce nemoci měla po předchozích zánětech velké pseudopolypy a subklinické vazivové stenózky tračníku. 2017 byl nalezen na zhojeném rektu plošný tubulární adenom, který byl endoskopicky odstraněn. V únoru 2019 se v orálním sigmatu objevil další plošný adenom, který ale nešlo endoskopicky odstranit. Proto, a vzhledem i k riziku příp. dalších neoplázií v budoucnu, již pacientka souhlasila s chirurgickým řešením. V říjnu 2019 byla provedena subtotální kolektomie a resekce 1m tenkého střeva a terminální ileostomie. Po operaci bylo vzhledem k závažnosti stavu domluveno s pojišťovnou podávání vedolizumabu. 2020 a 2021 měla 3x po dietních chybách (vláknina) subileózní stavy i s nutností hospitalizace. Jinak byla zcela bez gastrointestinálních potíží. Její jediné potíže (revmatologické) nesouvisely se zánětem střeva. Vzhledem k subileózním stavům a jinak výborné kondici bylo na 04/21 domluveno rozrušení srůstů a proktektomie.
Komentář:
Pokud by nedošlo ke zklidnění zánětu, nebylo by možné nalézt a vyřešit adenomy tračníku.
Obrázky:
C-APROM/CZ/ENTY/0045

