Autor článku: MUDr. Štefan Konečný, FN Brno Bohunice, oddělení Gastroenterologie
Anamnéza celková:
Muž, 39 let, M. Crohn, jinak bez dalších komorbidit.
Anamnéza IBD:
Primodiagnostika listopad 2018. Již od roku 2008 vyšetřován na gastroenterologii pro recidivující dyspepsie. V listopadu 2018 relativně náhle vzniklé bolesti pravého podbřišku křečového rázu, bez zvracení, bez průjmů, bez febrilií. Hospitalizován na chirurgii pro suspektní appendicitidu, appendektomie neprovedena pro nález zánětlivého postižení oblasti IC přechodu, na ATB terapii metronidazolem došlo k ústupu obtíží. Poté předán do péče gastroenterologa.
Anamnéza farmakologická:
Mesalazin od ledna 2019 do ledna 2020, od května 2020 do listopadu 2020 adalimumab, od listopadu 2020 do dubna 2021 ustekinumab, od června 2021 vedolizumab.
Popis případu:
V lednu 2020 se u našeho pacienta objevili postupně se zhoršující klidové bolesti v oblasti konečníku horšící se při stolici. Pacient byl bez febrilií, nauzey či dalších potíží. Při vyšetření per rektum byla za svěračem hmatná bolestivá rezistence s fluktuací. Laboratorně byla přítomná elevace zánětlivých parametrů. Dle ultrazvuku abscesová formace vlevo od análního kanálu. Proto byla následně provedena incize abscesu v celkové anestezii s vyprázdněním dutiny s hnisem a byla nasazena i.v. ATB terapie. Další průběh byl bez komplikací, lokální nález zklidněn a následně vytažen korýtkový drén. V květnu 2020 byla zahájena biologická terapie adalimumabem, při následující kontrole v srpnu 2020 byl stav hodnocen jako dobrý efekt biologické terapie s indikací dalšího pokračování v léčbě. V listopadu 2020 se ale rozvinul kožní nález na bércích dolních končetin, dermatologem hodnoceno jako psoriáza – paradoxní reakce na anti-TNF α terapii adalimumabem. Proto byla indikována změna biologické terapie na non-anti-TNF α biologikum. V listopadu 2020 zahájena terapie ustekinumabem. V dubnu 2021 ale došlo k recidivě píštěle a periproktálního (horseshoe) abscesu, s nutností chirurgického řešení, kdy 29.4.2021 byla provedena incize a exstirpace a zavedeny korýtkové drény. Vzhledem ke zhoršení perianální nemoci na terapii ustekinumabem, byl stav hodnocen jako selhání terapie ustekinumabem a od června 2021 byla indikovaná změna biologické terapie na vedolizumab.
Při kontrolním MR vyšetření 11.10.2021 zlepšení nálezu, regrese abscesových kolekcí a prosáknutí perianálně a zlepšení klinického stavu nemocného, proto nadále pokračujeme v terapii vedolizumabem ve standardním dávkování 300 mg á 8 týdnů.
Komentář:
Perianální Crohnova nemoc je těžkou agresivní a obtížně zvladatelnou formou Crohnovy nemoci s frekventními relapsy, častými chirurgickými intervencemi a zhoršenou kvalitou život nemocných. Perianální píštěle postihují 17-50 % pacientů s Crohnovou nemocí, kumulativní incidence stoupá s délkou trvání Crohnovy nemoci.1 Léčba pacientů s perianální Crohnovou nemocí a předchozí antibiotickou a biologickou léčbou bývá komplikovaná a přestavuje terapeutickou výzvu. V literatuře jsou informace o účinnosti vedolizumabu u perianální Crohnovy nemoci velmi sporé a výsledky prvních studií ve srovnání s ustekinumabem2,3 vykazovali mírně nižší účinnost.4 Nicméně nejnovější dostupná data ukazují vyšší účinnost vedolizumabu5 při standardním dávkování se zachováním příznivého bezpečnostního profilu.6 V našem případě došlo ke zřetelnému zlepšení klinického stavu a nálezu na zobrazovacích metodách po podání čtvrté dávky vedolizumabu a tento efekt dále přetrvává i po páté infuzi. Naše kazuistika ukazuje, že vedolizumab může být účinný i u pacientů s perianální Crohnovou nemocí po předchozí antibiotické a biologické léčbě se selháním druhé řady non-anti-TNF α biologik.
Obrazová dokumentace:
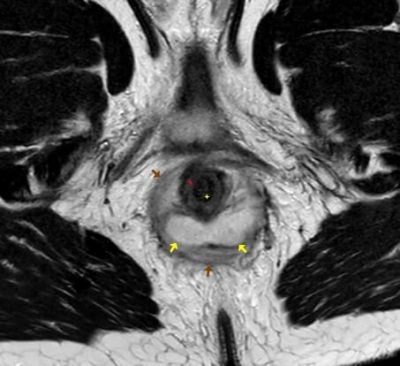
Obr. 1.: MR pánve ze dne 29.04.2021. T2 vážený obraz, axiálně. Na obrázku je patrné rektum (stěna označená červenou hvězdou, lumen žlutou). Dorzálně od rekta na čísle 3-9 je hyperintenzní abscesová kolekce (žluté šipky) v okolí pak prosáknutí měkkých tkání (hnědé šipky).
Klinika radiologie a nukleární medicíny FN Brno
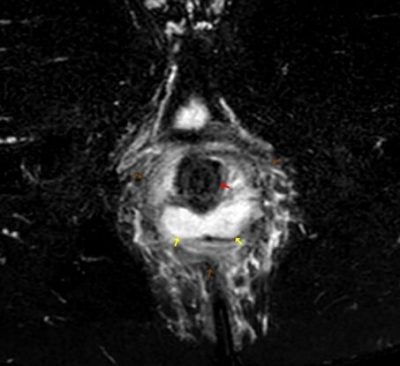
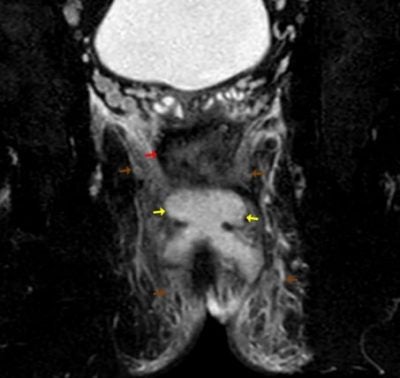
Obr. 2,3.: MR pánve ze dne 29.04.2021. T2 vážený obraz s potlačením tuku, axiálně (2), koronárně (3). Na obrázku je patrné rektum (červená šipka). Dorzálně od rekta na čísle 3-9 je hyperintenzní abscesová kolekce (žluté šipky) v okolí pak prosáknutí měkkých tkání (hnědé šipky), které je výrazné především v blízkém okolí abscesu a méně pokračuje i do periferie. Ve srovnání s klasickým T2 váženým obrazem je prosáknutí lépe patrné na sekvenci s potlačením tuku.
Klinika radiologie a nukleární medicíny FN Brno
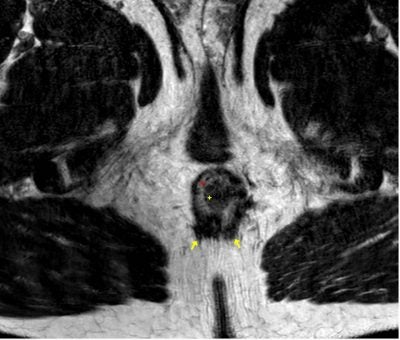
Obr. 4.: kontrolní MR pánve ze dne 11.10.2021. T2 vážený obraz, axiálně. Na obrázku je patrné rektum (stěna označená červenou hvězdou, lumen žlutou). Perirektálně již abscesová kolekce není patrná (její původní místo označeno žlutými šipkami). Rovněž došlo k regresi prosáknutí měkkých tkání.
Klinika radiologie a nukleární medicíny FN Brno
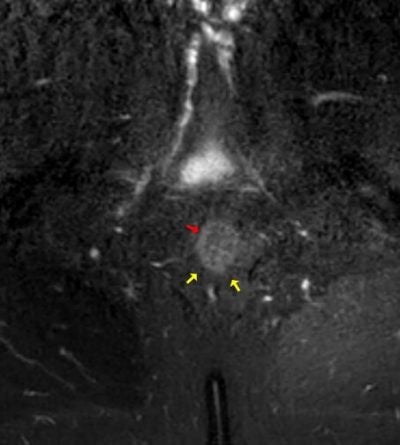
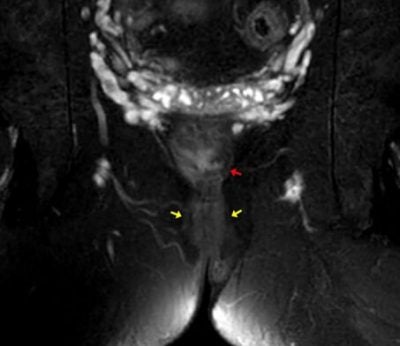
Obr. 5,6.: kontrolní MR pánve ze dne 11.10.2021. MR pánve (s odstupem 5,5 měsíce). T2 vážený obraz s potlačením tuku, axiálně (5), koronárně (6). Na obrázku je patrné rektum (červená šipka). Perirektálně již abscesová kolekce není patrná (její původní místo označeno žlutými šipkami). Rovněž došlo k regresi prosáknutí měkkých tkání. Klinika radiologie a nukleární medicíny FN Brno
Reference:
- ZBOŘIL, Vladimír. Idiopatické střevní záněty. Praha: Mladá fronta, 2018.
- Chapuis-Biron C, Kirchgesner J, Pariente B, et al. Ustekinumab for Perianal Crohn’s Disease: The BioLAP Multicenter Study From the GETAID. Am J Gastroenterol. 2020;115:1812-1820.
- Attauabi M, Burisch J, Seidelin JB. Efficacy of ustekinumab for active perianal fistulizing Crohn’s disease: a systematic review and meta-analysis of the current literature. Scand J Gastroenterol. 2021;56:53-58.
- Chapuis-Biron C, Bourrier A, Nachury M, et al. Vedolizumab for perianal Crohn’s disease: a multicentre cohort study in 151 patients. Aliment Pharmacol Ther. 2020;51:719-727.
- Schwartz DA, Peyrin-Biroulet L, Lasch K, et al. Efficacy and Safety of 2 Vedolizumab Intravenous Regimens for Perianal Fistulizing Crohn’s Disease: ENTERPRISE Study. Clin Gastroenterol Hepatol. 2021:S1542-3565(21)01042-9. Epub ahead of print.
Feagan BG, Schwartz D, Danese S, et al. Efficacy of Vedolizumab in Fistulising Crohn’s
C-APROM/CZ/ENTY/0045

