MUDr. Jakub Jirsa, ISCARE a.s.
Anamnéza celková:
Žena, ročník 1968, 54 let
Stp. Covid-19 v 1/2022
Operace: stp. operaci ingvinální hernie r. 1971, stp. hysterektomii r. 2014
Alergie: metronidazol, ciprofloxacin (celotělový exantém)
Anamnéza IBD:
Ulcerózní kolitida, dg. 12/2014
- V době dg. levostranný tvar, dle Montrealské klasifikace E2
- Kortikodependentní, kortikorefrakterní průběh
- Terapie infliximab 7/2015 – 10/2018, ukončeno pro ztrátu odpovědi
- Terapie vedolizumab 11/2018 – 1/2019, ukončeno pro neodpovídavost po indukci
- Proktokolektomie s ileopouch-anální anastomózou (IPAA) ve 3 dobách
- 23.1.2019 subtotální kolektomie, terminální ileostomie, mukózní píštěl rekta
- 16.4.2019 proktektomie, konstrukce J pouche a IPAA, protektivní axiální ileostomie
- 10.7.2019 zanoření stomie, obnovení střevní kontinuity
- Pouchoskopie 3/2022 s obrazem pouchitis, histologicky verifikováno
- Terapie vedolizumab od 3/2022
- Pouchoskopie 9/2022 s normálním nálezem
Anamnéza farmakologická:
- 5-ASA per os i lokálně – dlouhodobě před operací r. 2019
- budesonid per os i lokálně – opakovaně před operací r. 2019
- Systémové kortikosteroidy – opakovaně před operací r. 2019
- azathioprin od 6/2015 do 1/2019, maximální dávka 100mg, vysazeno perioperačně
- antidiarhoika a probiotika od obnovení střevní kontinuity v 7/2019
- iologická terapie (infliximab, vedolizumab): podrobněji viz anamnéza IBD
Popis případu:
Pacientka s dg. ulcerózní kolitidy při koloskopii v 12/2014, vstupně levostranný tvar, endoskopicky hodnoceno jako Mayo 2. V popředí průjmovitá stolice 6-8x denně, urgence, intermitentně krev ve stolici, váhový úbytek 4kg. Indukční terapie systémovými kortikoidy s efektem, při postupné detrakci pod 10mg/den opětovné zhoršení. Pro kortikodependenci zahájena biologická terapie infliximab (IFX) v klasickém indukčním režimu. Poté výrazné zlepšení stavu, stolice 1x denně, bez krve, systémové kortikosteroidy úspěšně vysazeny, kontrolní rektoskopie z 10/2015 se zřetelným zlepšením – endoskopicky hodnoceno jako Mayo 1 v rektu, dále Mayo 0.
Od 7/2018 postupné zhoršení stavu s častými stolicemi s příměsí krve, Clostridium difficile (C-diff) negativní, rektoskopie s obrazem Mayo 3 v rektosigma, zdravého okraje nedosaženo. Intenzifikace IFX na 10mg/kg. V 11/2018 rektoskopie bez zlepšení endoskopického obrazu, pro ztrátu odpovědi IFX ukonče, zahájena terapie vedolizumab (VDZ).
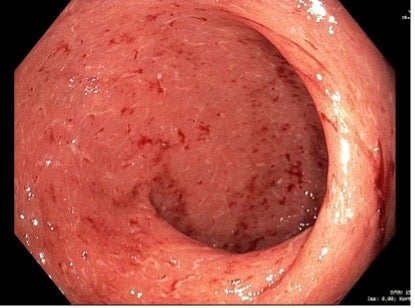
Obr. 1: Těžké zánětlivé změny v rektu (Mayo 3) při rektoskopii v 11/2018, nález vedl ke změně biologické terapie z IFX na VDZ
Po indukční fázi VDZ nedochází ke zlepšení, opakovaně vyloučeno C-diff. V 1/2019 hospitalizace, i přes aplikaci i.v. kortikosteroidů a antibiotik stav stacionární, rozhodnuto o provedení proktokolektomie s IPAA ve 3 dobách (podrobně viz. Anamnéza IBD). Pooperační průběh bez komplikací.
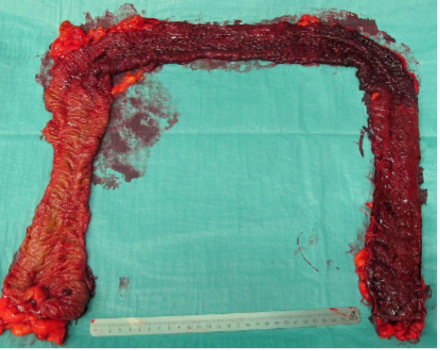
Obr. 2: Operační resekát z 1/2019: 40mm terminálního ilea a 740mm dlouhá část kolon – od jaterního ohbí aborálně makroskopicky překrvená sliznice, mikroskopicky ve zmíněné části popsána výrazná zánětlivá celulizace, kryptové abscesy a ulcerace.
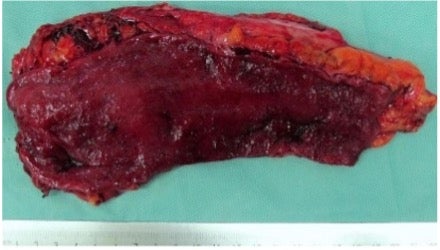
Obr. 3: Operační resekát z 4/2019: 140mm dlouhá část kolon – sliznice polypózně zbytnělá s hojnou zánětlivou celulizací.
Od obnovení střevní kontinuity v 7/2019 četné stolice až 20x denně. Zavedena protiprůjmová terapie loperamid, magistraliter calciové prášky bez kodeinu (kodein nepodáván pro slabost) a kolestyramin s postupnou titrací dle tolerance. Poté ustálení počtu stolic na 4x přes den, 3x v noci, kontinence přes den plná, v noci občasně malý únik. Dále po obnovení střevní kontinuity nasazena probiotika, která dle některých studií signifikantně snižují risk vzniku pouchitis (1).
Kontrolní pouchoskopie v 12/2019 s přiměřeným nálezem. Pro občasnou noční inkontinenci v 4/2021 doplněna anorektální manometrie prokazující hypotonus análního svěrače s normální kontraktilitou, zahájena rehabilitace s použitím biofeedback. Po biofeedback kontinence zlepšena.
V 1/2022 pacientka prodělala Covid-19, krátce poté udává zvýšení počtu stolic (12x/den), nově pálení u konečníku, občasné bolesti břicha a mírný váhový úbytek (-2kg). Proto byla v 3/2022 provedena kontrolní pouchoskopie s obrazem pouchitis, histologicky verifikováno, cytomegalovirus (CMV) negativní, C-diff negativní.
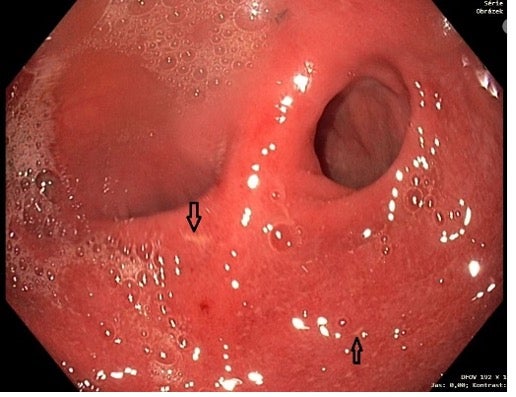
Obr. 4: Pouchoskopie 3/2022 s obrazem difúzně křehčí, edematózní sliznice, patrné drobné vřídky (viz. šipky)
Pro pozitivní alergickou anamnézu nebylo možné zahájení ATB terapie ciprofloxacin či metronidazol. Pacientka byla přeléčena vancomycin per os v dávce 500mg/den na 10 dní, bez většího klinického efektu. Poté byla předepsána léčba rifaximin v dávce 1200mg/den na 10 dní, taktéž bez většího klinického úspěchu. Stále trvá navýšený počet stolic, občasné bolesti břicha.
Pro pouchitis rezistentní na běžnou antibiotickou terapii byla zahájena v 3/2022 terapie VDZ (2). Již během indukční fáze došlo postupně ke snížení počtu stolic a vymizení bolestí břicha. Po indukční fázi pokračováno v intervalu aplikace VDZ 300mg i.v. á 4 týdny. V 8/2022 kontrolní anorektální manometrie se stacionárním nálezem, nadále rehabilitace pánevního dna. V 9/2022 kontrolní pouchoskopie s normálním nálezem, bez známek pouchitis.
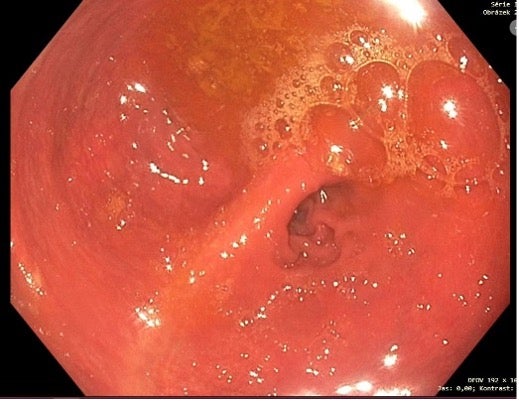
Obr. 5: Pouchoskopie 9/2022 – sliznice pouche klidná, bez vřídků
Po zahájení terapie VDZ se podařilo dosáhnout stabilního stavu, pacientka má nyní v průměru 5 stolic přes den, 3 v noci, trvá občasná noční inkontinence, probíhá rehabilitace. Pokračuje v terapii VDZ á 4 týdny. Hladina VDZ se pohybuje v rozmezí 40-60 mg/l, protilátky jsou negativní. Fekální kalprotektin opakovaně pod 20 μg/g stolice, CRP v normě. Z ostatní medikace pravidelně užívá protiprůjmové léky a probiotika.
Reference:
- Gionchetti P, Rizzello F, Helwig U, Venturi A, Lammers KM, Brigidi P, Vitali B, Poggioli G, Miglioli M, Campieri M. Prophylaxis of pouchitis onset with probiotic therapy: a double-blind, placebo-controlled trial. Gastroenterology. 2003 May;124(5):1202-9
- Philpott J, Ashburn J, Shen B. Efficacy of Vedolizumab in Patients with Antibiotic and Anti-tumor Necrosis Alpha Refractory Pouchitis. Inflamm Bowel Dis. 2017 Jan;23(1):E5-E6.
C-APROM/CZ/ENTY/0116

