Jméno lékaře, pracoviště: MUDr. Eva Meisnerová, IV.Interní klinika VFN Praha
Anamnéza:
IBD:
žena nar. 1957
- 1973 (16 let) Apendektomie
- 1988 (31 let) Hysterektomie (myomy)
- 2000 (43 let) Cholecystektomie
- 2001 (44 let) revize pro ileus ze srůstu
- 2010 (53 let)
- Laparoskopická revize pro bolestivý pánevní syndrom
- Adnexectomie
2-4/2010
- Mnohočetné perforace tenkého střeva
- Opakované revize
- Založena jejunostomie (30 cm), mukozní píštěl ileum (10cm)
- Intestinální selhání dle Pironi D4
- 20kcal/kg /den >3000 infuzní léčby
- 4.2010 domácí parenterální výživa
- 3.2011 obnovena střevní kontinuita
Domácí parenterální výživa 2011-2021
- Infekční komplikace
- 12/2010 Infekce katetru s návazností na koloskopii (Enteroccus feacalis ) – extrakce katetru
- 5/2015 G neg. tyč. Corynebacteria nocardie konzervativní léčba
- Osteopenie
- Deficit vitaminu D
- Jaterní steatosa
O 12 let později
- Žena 65let
- Intestinální selhání dle Pironi C4 (15kcal/den >3000 ml)
- 4-6 stolic dle perorálního příjmu
- S parenterální výživou smířena
- Hmotnost stabilní
- Složení parenterální výživy se příliš nemění
- Hydratace si pacientka upravuje dle klimatických podmínek
- Velmi se obává jakékoliv nové medikace
- Kontroly 4x ročně
- Současně přemýšlí, jak bude vše zvládat sama v budoucnu ….
Farmakologická – IBD a SBS:
- Leden 2022 po provedení kolonoskopického vyšetření
- Nejsou přítomny polypy
- Laboratoř stabilní
- Není přítomna malignita
- Není gravidita ani kojení
- Zahájena aplikace Revestive 0,3 ml tj 3mg hluboko s.c.
Klinická kontrola 5.4.
- Po 69 dnech léčby přerušena parenterální výživa
- Ponechána hydratační infuzní léčba
- 6x týdně balancovaný krystaloid
- den Léčby (26.5.)
- Stolice 1x denně nebo obden
- Hmotnostně + 2kg
- Biochemie zcela v normě
- Upravena infuzní léčba dle počtu stolic na 3-4x týdně 1000 ml krystaloidu
- den léčby (26.8.)
- Stolice 1x denně nebo obden
- Hmotnostně stabilní
- Laboratoř v normě
- Přerušena infuzní léčba
- Nadále denní aplikace Revestive 0,3 ml tj 3mg hluboko s.c.
Přehled laboratorních výsledků
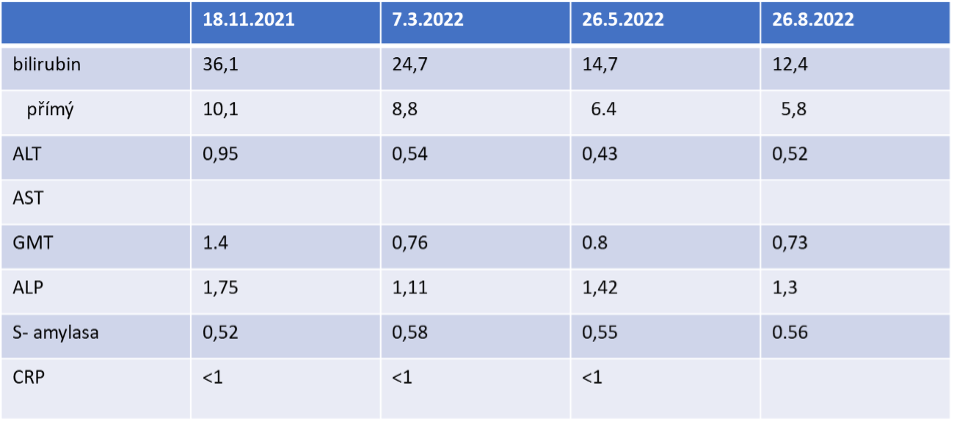
Závěr:
Klinické zkušenosti s Teduglutidem
Léčba je nadějí na ukončení parenterální výživy, pokud není vhodná rekonstrukce GIT.
V prezentovaném klinickém případu jsme nezaznamenali nežádoucí účinky léčby.
Reakce pacientky: „Jsem nadšená, celou noc spím“
Reference: archiv a zdravotní dokumentace u autora
C-APROM/CZ/REV/0056
Datum přípravy: 10/2022
ENTYVIO
Zkrácené informace o přípravku:
Název: Entyvio 300 mg prášek pro koncentrát pro infuzní roztok (i.v.). Entyvio 108 mg injekční roztok v předplněném peru (s.c.). Složení: Entyvio 300 mg: Jedna injekční lahvička obsahuje vedolizumabum 300 mg. Po rekonstituci jeden ml obsahuje vedolizumabum 60 mg. Seznam pomocných látek viz SPC. Entyvio 108 mg: Jedno předplněné pero obsahuje vedolizumabum 108 mg v 0,68 ml. Seznam pomocných látek viz SPC. Indikace: Entyvio i.v. + s.c. Léčba dospělých pacientů se středně těžkou až těžkou aktivní ulcerózní kolitidou (UC) nebo se středně těžkou až těžkou aktivní Crohnovou chorobou (CD), u nichž buď nastala neadekvátní odpověď na konvenční terapii nebo na antagonistu tumor nekrotizujícího faktoru alfa (TNFα), nebo došlo ke ztrátě odpovědi na léčbu, nebo kteří uvedenou léčbu netolerují. Entyvio i.v.: indikován k léčbě dospělých pacientů se středně těžkou až těžkou aktivní chronickou pouchitidou, kteří podstoupili proktokolektomii s ileopouch-anální anastomózou v rámci léčby ulcerózní kolitidy a mají nedostatečnou odpověď na antibiotickou léčbu nebo na ni přestali odpovídat. Dávkování a způsob podání: Entyvio 300 mg: Doporučená dávka je 300 mg podávaných i.v. infuzí v týdnu 0, 2 a 6, a dále pak každých 8 týdnů (viz SPC); Entyvio 108 mg: Subkutánně podávaný vedolizumab (108 mg) je určen pro udržovací léčbu podávanou po alespoň 2 intravenózních infuzích, každé 2 týdny (viz SPC). Bezpečnost a účinnost vedolizumabu u dětí ve věku od 0 do 17 let nebyla dosud stanovena. U starších pacientů se úprava dávkování nevyžaduje. Kontraindikace: Hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Aktivní závažné infekce, jako jsou tuberkulóza, sepse, cytomegalovirus, listerióza, a oportunní infekce, jako je progresivní multifokální leukoencefalopatie (PML). Zvláštní upozornění: U pacientů, kterým byl podáván vedolizumab, byly hlášeny reakce související s infuzí (IRR) nebo reakce v místě aplikace a hypersenzitivní reakce. Existuje potenciální zvýšené riziko oportunních infekcí nebo infekcí, pro něž je střevo ochrannou bariérou. Před zahájením léčby musí být pacienti vyšetřeni na tuberkulózu. Souběžné používání přípravku s biologickými imunosupresivy se nedoporučuje. Při léčbě se může pokračovat v očkování neživými vakcínami. Entyvio 300 mg: Všechny pacienty je třeba nepřetržitě sledovat během každé infuze a dále přibližně 1 hodinu (u prvních 2 infuzí 2 hodiny) po ukončení infuze. Lékové interakce: Společné podávání kortikosteroidů, imunomodulátorů a aminosalicylátů nemá klinicky významný účinek na farmakokinetiku vedolizumabu. Živé vakcíny, zejména perorální živé vakcíny, je nutno s vedolizumabem používat s opatrností. Nežádoucí účinky: Nejčastěji hlášenými nežádoucími účinky jsou infekce (jako jsou nazofaryngitida, infekce horních cest dýchacích, bronchitida, chřipka a sinusitida), bolest hlavy, nauzea, pyrexie, únava, kašel, artralgie. Byly také hlášeny reakce v místě injekce nebo v místě aplikace. Ostatní viz SPC. Zvláštní požadavky na podmínky uchovávání: Entyvio 300 mg:Injekční lahvičku nutno chránit před světlem, uchovávejte v chladničce (2 °C - 8 °C) Entyvio 108 mg: Nutno chránit před světlem, Uchovávejte v chladničce (2 °C - 8 °C) Chraňte před mrazem. Předplněné pero je možno ponechat mimo chladničku v původní krabičce při pokojové teplotě (až do 25 °C) po dobu až 7 dnů. Držitel rozhodnutí o registraci: Takeda Pharma A/S, Delta Park 45, 2665 Vallensbaek Strand, Dánsko. Registrační číslo: EU/1/14/923/001,005-007. Datum poslední revize: Entyvio s.c. – 3/2024. Datum poslední revize Entyvio i.v. – 3/2024
Přípravek Entyvio 300 mg je v indikaci CD a UC hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Přípravek Entyvio 108 mg je hrazen z prostředků veřejného zdravotního pojištění a je vydáván pouze na lékařský předpis. Před předepsáním se seznamte s úplným zněním Souhrnů údajů o přípravcích.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na SÚKL nebo společnosti Takeda emailem na AE.CZE@takeda.com
REVESTIVE
Zkrácené informace o léčivém přípravku
Revestive 1,25 mg prášek a rozpouštědlo pro injekční roztok
Revestive 5 mg prášek a rozpouštědlo pro injekční roztok
![]() Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8 SPC.
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8 SPC.
Složení: Jedna injekční lahvička s práškem obsahuje 1,25 mg, resp.5 mg teduglutidu. Po rekonstituci jedna injekční lahvička obsahuje 1,25 mg teduglutidu v 0,5 ml roztoku, což odpovídá koncentraci 2,5 mg/ml, resp.5mg teduglutidu v 0,5ml roztoku, což odpovídá koncentraci 10mg/ml. Seznam pomocných látek viz SPC. Indikace: Léčba pacientů ve věku od 4 měsíců korigovaného gestačního věku se syndromem krátkého střeva (Short Bowel Syndrome, SBS). Stav pacientů by měl být po uplynutí období pooperační adaptace střeva stabilní. Dávkování a způsob podání: Doporučená dávka Revestivu je 0,05 mg/kg tělesné hmotnosti jednou denně. Objemy injekce pro aplikaci ve vztahu k tělesné hmotnosti jsou uvedeny v SPC. Rekonstituovaný roztok má být podáván subkutánní injekcí jednou denně, a to střídavě do jednoho ze čtyř kvadrantů břicha. Kontraindikace: Hypersenzitivita na léčivou/kteroukoli pomocnou látku/stopová rezidua tetracyklinu. Aktivní nebo suspektní malignita.Pacienti s anamnézou výskytu maligního onemocnění gastrointestinálního traktu včetně hepatobiliárního systému a pankreatu v posledních pěti letech Upozornění: Dospělí: Kolorektální polypy: Při zahájení léčby Revestivem je třeba provést kolonoskopii, včetně odstranění polypů. V průběhu prvních 2 let léčby se doporučují kolonoskopické kontroly jednou ročně, následně minimálně v pětiletých intervalech (nebo alternativní zobrazovací metody). V případě výskytu malignity musí být léčba přerušena. Neoplazie gastrointestinálního traktu *: U pacientů s SBS byla pozorována tvorba polypů tenkého střeva byla během několika měsíců po zahájení léčby teduglutidem. Z tohoto důvodu se před léčbou a v jejím průběhu doporučuje endoskopie horního gastrointestinálního traktu nebo jiné zobrazovací metody. V případě výskytu malignity musí být léčba přípravkem přerušena Je třeba přehodnotit nutnost další léčby v případě výskytu symptomů vázaných na: žlučník, žlučové cesty, slinivku břišní, rekurentní výskyt střevní obstrukce. Přetížení krevního oběhu tekutinami/dehydratace: Vzhledem ke zvýšené absorpci tekutin je třeba pacienty s kardiovaskulárním onemocněním, jako např. srdeční nedostatečností a hypertenzí, monitorovat s ohledem na přetížení oběhu tekutinami, a to především při zahájení léčby. V klinických hodnoceních bylo pozorováno kongestivní srdeční selhání. Pacienti s SBS mají sklon k dehydrataci, která může vést k akutnímu selhání ledvin. U pacientů léčených přípravkem Revestive má být míra parenterální podpory snižována opatrně a nemá se ukončit náhle. Pacienty, kterým jsou podávány souběžně perorální léčivé přípravky vyžadující titraci nebo přípravky s úzkým terapeutickým indexem, je třeba pečlivě sledovat kvůli možné zvýšené absorpci.Pediatrická populace: viz také obecná opatření pro dospělé v tomto bodě. U všech dětí a dospívajících má být před zahájením léčby proveden test okultního krvácení do stolice, po dobu užívání, následně každý rok. Kolonoskopické/sigmoideoskopické vyšetření je požadováno, pokud existuje důkaz nevysvětlitelné přítomnosti krve ve stolici, dále se doporučuje po jednom roce léčby a každých 5 let, nebo pokud se objeví nové nebo nevysvětlitelné gastrointestinální krvácení. Při každém podání Revestivu se důrazně doporučuje zaevidovat jméno a číslo šarže přípravku, aby se zachovala spojitost mezi pacientem a šarží přípravku. Interakce: Nebyly provedeny žádné klinické farmakokinetické studie lékových interakcí. Hlavní nežádoucí účinky: Nejčastěji uváděnými nežádoucími účinky byly bolest břicha a distenze, infekce dýchacích cest, nauzea, reakce v místě vpichu, bolest hlavy a zvracení. Přibližně 38 % léčených pacientů se stomií zaznamenalo komplikace související s gastrointestinální stomií. Ostatní viz SPC. Účinky na schopnost řídit a obsluhovat stroje: Revestive má malý vliv na schopnost řídit, jezdit na kole nebo obsluhovat stroje. Uchovávání: Revestive 1,25mg: uchovávejte v chladničce (2 °C – 8 °C). Chraňte před mrazem. Revestive 5mg: uchovávejte při teplotě do 25 °C. Chraňte před mrazem.
Držitel rozhodnutí o registraci: Takeda Pharmaceuticals International AG Ireland Branch, Dublin, Irsko.
Registrační čísla: EU/1/12/787/001-003
Poslední revize SPC: 07/2024
*Všimněte si, prosím, změn v informacích o léčivém přípravku.
Výdej léčivého přípravku je vázán na lékařský předpis.
Léčivý přípravek je hrazen z prostředků veřejného zdravotního pojištění.
Úplné znění SPC naleznete na www.sukl.cz.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na SÚKL nebo společnosti Takeda emailem na AE.CZE@takeda.com. Podezření na nežádoucí účinky hlaste také podle národních legislativních požadavků.

