Zkrácené informace o léčivém přípravku
Revestive 1,25 mg prášek a rozpouštědlo pro injekční roztok
Revestive 5 mg prášek a rozpouštědlo pro injekční roztok
Dříve než začnete přípravek předepisovat, seznamte se, prosím, s úplným souhrnem údajů o přípravku (SPC).
 Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8 SPC.
Tento léčivý přípravek podléhá dalšímu sledování. To umožní rychlé získání nových informací o bezpečnosti. Žádáme zdravotnické pracovníky, aby hlásili jakákoli podezření na nežádoucí účinky. Podrobnosti o hlášení nežádoucích účinků viz bod 4.8 SPC.
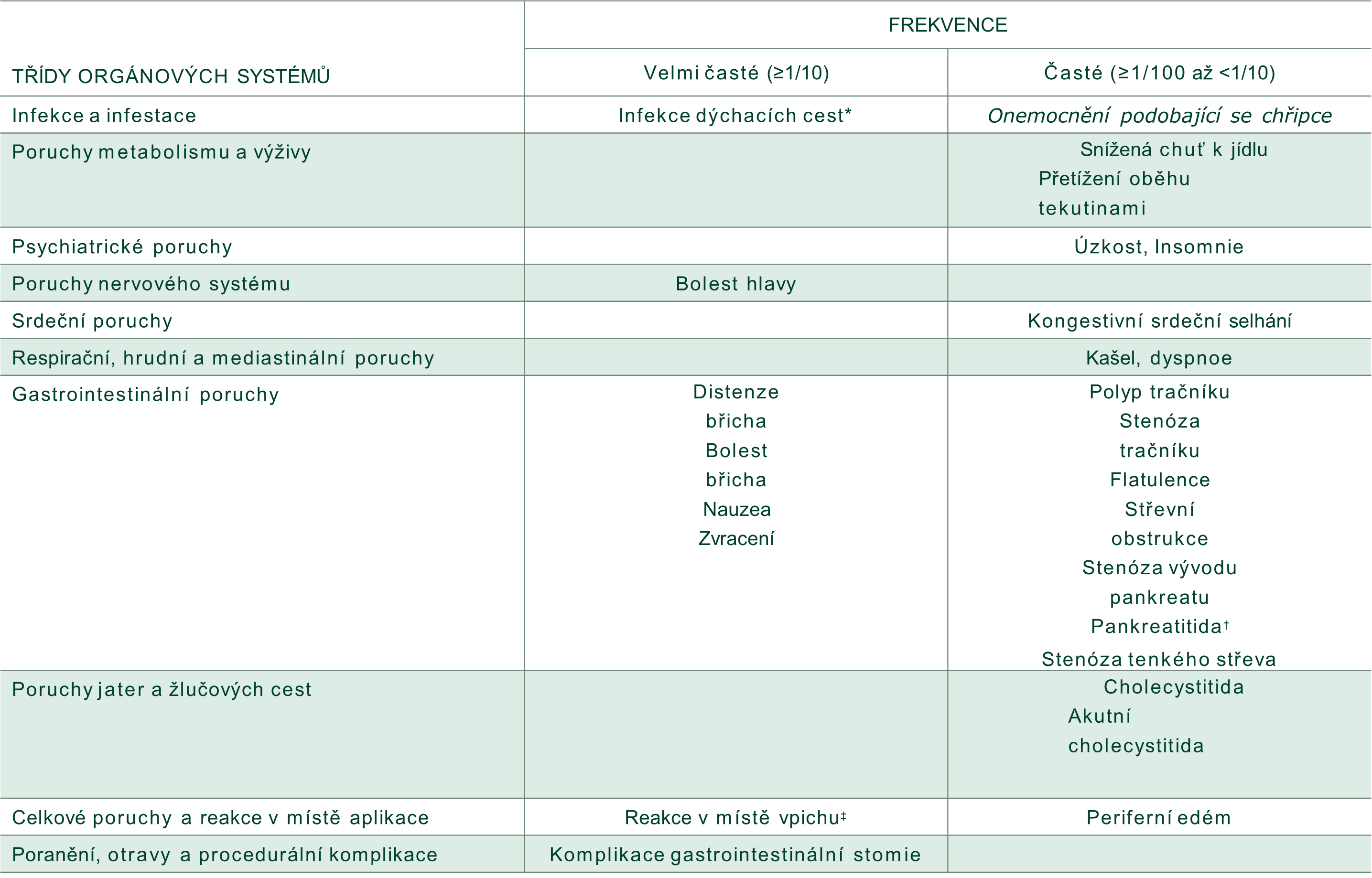
Složení: Jedna injekční lahvička s práškem obsahuje 1,25 mg, resp.5 mg teduglutidu. Po rekonstituci jedna injekční lahvička obsahuje 1,25 mg teduglutidu v 0,5 ml roztoku, což odpovídá koncentraci 2,5 mg/ml, resp.5mg teduglutidu v 0,5ml roztoku, což odpovídá koncentraci 10mg/ml. Seznam pomocných látek viz SPC. Indikace: Léčba pacientů ve věku od 4 měsíců korigovaného gestačního věku se syndromem krátkého střeva (Short Bowel Syndrome, SBS). Stav pacientů by měl být po uplynutí období pooperační adaptace střeva stabilní. Dávkování a způsob podání: Doporučená dávka Revestivu je 0,05 mg/kg tělesné hmotnosti jednou denně. Objemy injekce pro aplikaci ve vztahu k tělesné hmotnosti jsou uvedeny v SPC. Rekonstituovaný roztok má být podáván subkutánní injekcí jednou denně, a to střídavě do jednoho ze čtyř kvadrantů břicha. Kontraindikace: Hypersenzitivita na léčivou/kteroukoli pomocnou látku/stopová rezidua tetracyklinu. Aktivní nebo suspektní malignita.Pacienti s anamnézou výskytu maligního onemocnění gastrointestinálního traktu včetně hepatobiliárního systému a pankreatu v posledních pěti letech Upozornění: Dospělí: Kolorektální polypy: Při zahájení léčby Revestivem je třeba provést kolonoskopii, včetně odstranění polypů. V průběhu prvních 2 let léčby se doporučují kolonoskopické kontroly jednou ročně, následně minimálně v pětiletých intervalech (nebo alternativní zobrazovací metody). V případě výskytu malignity musí být léčba přerušena. Neoplazie gastrointestinálního traktu *: U pacientů s SBS byla pozorována tvorba polypů tenkého střeva byla během několika měsíců po zahájení léčby teduglutidem. Z tohoto důvodu se před léčbou a v jejím průběhu doporučuje endoskopie horního gastrointestinálního traktu nebo jiné zobrazovací metody. V případě výskytu malignity musí být léčba přípravkem přerušena Je třeba přehodnotit nutnost další léčby v případě výskytu symptomů vázaných na: žlučník, žlučové cesty, slinivku břišní, rekurentní výskyt střevní obstrukce. Přetížení krevního oběhu tekutinami/dehydratace: Vzhledem ke zvýšené absorpci tekutin je třeba pacienty s kardiovaskulárním onemocněním, jako např. srdeční nedostatečností a hypertenzí, monitorovat s ohledem na přetížení oběhu tekutinami, a to především při zahájení léčby. V klinických hodnoceních bylo pozorováno kongestivní srdeční selhání. Pacienti s SBS mají sklon k dehydrataci, která může vést k akutnímu selhání ledvin. U pacientů léčených přípravkem Revestive má být míra parenterální podpory snižována opatrně a nemá se ukončit náhle. Pacienty, kterým jsou podávány souběžně perorální léčivé přípravky vyžadující titraci nebo přípravky s úzkým terapeutickým indexem, je třeba pečlivě sledovat kvůli možné zvýšené absorpci.Pediatrická populace: viz také obecná opatření pro dospělé v tomto bodě. U všech dětí a dospívajících má být před zahájením léčby proveden test okultního krvácení do stolice, po dobu užívání, následně každý rok. Kolonoskopické/sigmoideoskopické vyšetření je požadováno, pokud existuje důkaz nevysvětlitelné přítomnosti krve ve stolici, dále se doporučuje po jednom roce léčby a každých 5 let, nebo pokud se objeví nové nebo nevysvětlitelné gastrointestinální krvácení. Při každém podání Revestivu se důrazně doporučuje zaevidovat jméno a číslo šarže přípravku, aby se zachovala spojitost mezi pacientem a šarží přípravku. Interakce: Nebyly provedeny žádné klinické farmakokinetické studie lékových interakcí. Hlavní nežádoucí účinky: Nejčastěji uváděnými nežádoucími účinky byly bolest břicha a distenze, infekce dýchacích cest, nauzea, reakce v místě vpichu, bolest hlavy a zvracení. Přibližně 38 % léčených pacientů se stomií zaznamenalo komplikace související s gastrointestinální stomií. Ostatní viz SPC. Účinky na schopnost řídit a obsluhovat stroje: Revestive má malý vliv na schopnost řídit, jezdit na kole nebo obsluhovat stroje. Uchovávání: Revestive 1,25mg: uchovávejte v chladničce (2 °C – 8 °C). Chraňte před mrazem. Revestive 5mg: uchovávejte při teplotě do 25 °C. Chraňte před mrazem.
Držitel rozhodnutí o registraci: Takeda Pharmaceuticals International AG Ireland Branch, Dublin, Irsko.
Registrační čísla: EU/1/12/787/001-003
Poslední revize SPC: 07/2024
*Všimněte si, prosím, změn v informacích o léčivém přípravku.
Výdej léčivého přípravku je vázán na lékařský předpis.
Léčivý přípravek je hrazen z prostředků veřejného zdravotního pojištění.
Úplné znění SPC naleznete na www.sukl.cz.
Žádáme zdravotnické pracovníky, aby hlásili podezření na nežádoucí účinky na SÚKL nebo společnosti Takeda emailem na AE.CZE@takeda.com. Podezření na nežádoucí účinky hlaste také podle národních legislativních požadavků.