Konvenční léčba
Cytomegalová infekce představuje typickou oportunní infekci po transplantacích solidních orgánů či alogenních transplantacích krvetvorných buněk, kdy jsou imunosuprimovaní pacienti ohroženi závažným invazivním poškozením tkáně a vyžadují kombinaci specifické anti-CMV terapie společně se snahou minimalizovat intenzitu imunitní suprese.2
K léčbě CMV infekce a onemocnění je v současnosti k dispozici omezený počet antivirotik. Perorální valganciklovir a intravenózní ganciklovir jsou antivirotika doporučovaná pro léčbu CMV infekce jako léky první volby. Perorální valganciklovir se obecně upřednostňuje pro prevenci a léčbu u mírnějších nebo asymptomatických forem onemocnění, zatímco intravenózní ganciklovir se používá v případě vážného průběhu infekce, vysokých virových náloží nebo v případě kontraindikace perorální léčby.2
Intravenózní podání gancikloviru je preferovanou počáteční léčbou pacientů po transplantaci se závažným a život ohrožujícím onemocněním CMV a s poruchou gastrointestinální absorpce. Jakmile nastane adekvátní klinická a virologická odpověď, může být léčba převedená na perorální formu.2
Efekt léčby je vyhodnocen na základě klinického vyhodnocení symptomů a pomocí CMV PCR testu 1x týdně. V případě nedostatečného efektu této léčby (nedosažení >1 log10 poklesu virové nálože po 2 týdnech vhodně dávkované antivirové terapie) nebo je-li terapie val/ganciklovirem kontraindikována, například z důvodu rizika hematologické toxicity, používá se pro léčbu CMV infekce/onemocnění intravenózně podávaný foskarnet a/nebo intravenózní cidofovir, ačkoliv nejsou v této indikaci registrovány.2,8,9
Právě neuspokojivá virologická a klinická odpověď po 2-3 týdnech konvenční antivirotické léčby naznačuje refrakterní nebo rezistentní CMV.2
Použití konvenčních antivirotik bývá v řadě případů spojeno s významnou toxicitou, která může vyústit v nutnost redukce léčebné dávky, s rizikem snížení účinnosti této terapie nebo jeho úplné vysazení.2
Dostupná CMV virostatická léčba a její mechanismus účinku3
| Antivirotikum | Mechanismus účinku |
|---|---|
|
ganciklovir |
Inhibice syntézy virové DNA, která probíhá jako: (a) kompetitivní inhibice inkorporace deoxyguanosintrifosfátu do DNA účinkem virové DNA polymerázy a (b) inkorporace ganciklovirtrifosfátu do virové DNA s následnou terminací nebo (velmi omezeně) další elongací virové DNA6 |
|
valganciklovir |
Proléčivo s vyšší biologickou dostupností perorální formy ve srovnání s ganciklovirem7 |
|
foscarnet |
Přímá inhibice virové specifické DNA polymerázy a reverzní transkriptázy8 |
|
cidofovir |
Selektivní inhibice syntézy virové DNA9 |
|
letermovir |
Inhibice DNA terminázového komplexu CMV10 |
|
maribavir |
Inhibice CMV UL97 protein kinázy1 |
Mechanismus účinku konvenčních antivirotik spočívá v inhibici virové DNA polymerázy. Nicméně většina konvenčních antivirotik musí být aplikována intravenózně a jsou spojena s výskytem nežádoucích účinků, které pacientům způsobující další problémy. Jejich účinnost tedy zůstává omezena toxicitou, lékovou rezistencí, zkříženou rezistencí a dalšími problémy.3
Léčba maribavirem
Perorální léčba maribavirem je v současné době preferovanou léčbou pacientů s refrakterní a rezistentní CMV infekcí/nemocí. Perorální maribavir se rychle vstřebává s 30 – 40% biologickou dostupností. Koncentrace v ustáleném stavu je dosažena po 2 dnech podávání 2x denně.2
Maribavir se odlišuje od současných CMV antivirotik v profilu nežádoucích účinků.
Indikace k léčbě CMV infekce by měla být vždy přísně individuální, respektovat její tíži (CMV infekce vs. CMV nemoc), stav nemocného a rizika nežádoucích účinků léčby.4
Ve srovnání s konvenčními antivirotiky přináší maribavir tyto výhody:3,5
perorální podání bez nutnosti hospitalizace
méně toxický a bez vážných vedlejších účinků jako je myelotoxicita a nefrotoxicita
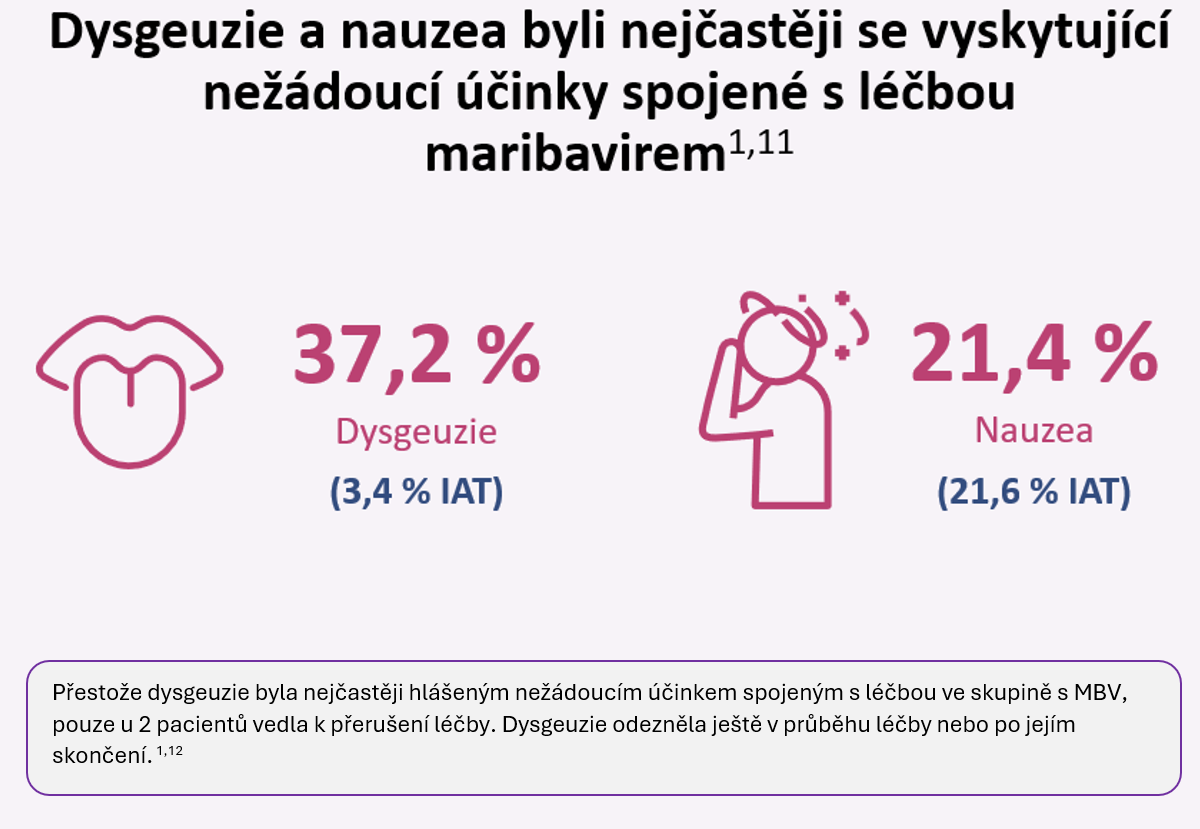
nejčastěji hlášený nežádoucí účinek v klinických studiích byla dysgeuzie (změny chuti), která byla většinou popisována jako mírná a obvykle vymizela buď během léčby nebo krátce po jejím skončení
z důvodu odlišného mechanismu účinku je účinný proti kmenům CMV, které jsou rezistentní na konvenční antivirotika a nehrozí vysoké riziko zkřížené rezistence s jinými antivirotiky
Kvantifikace CMV DNA je hlavním parametrem monitorování účinnosti CMV antivirotik. Kvůli bezpečnosti je zde rovněž nezbytné sledování lékových interakcí. Na začátku léčby maribavirem u imunokompromitovaných pacientů je nutné sledovat hladiny imunosupresiv. Výskyt neutropenie a akutního poškození ledvin byl ve studiích nízký a měl by vyžadovat pouze rutinní sledování u těch pacientů, u nichž byla přítomna cytopenie nebo chronické onemocnění ledvin již před zahájením terapie. Celkově je maribavir účinnou a bezpečnou volbou pro terapii refrakterní CMV, kterou lze snadno podávat a monitorovat.11
Podávání přípravku LIVTENCITY má zahájit lékař se zkušenostmi v léčbě pacientů, kteří podstoupili transplantaci solidního orgánu nebo transplantaci hematopoetických kmenových buněk.1
Interakce s jinými léčivými přípravky1
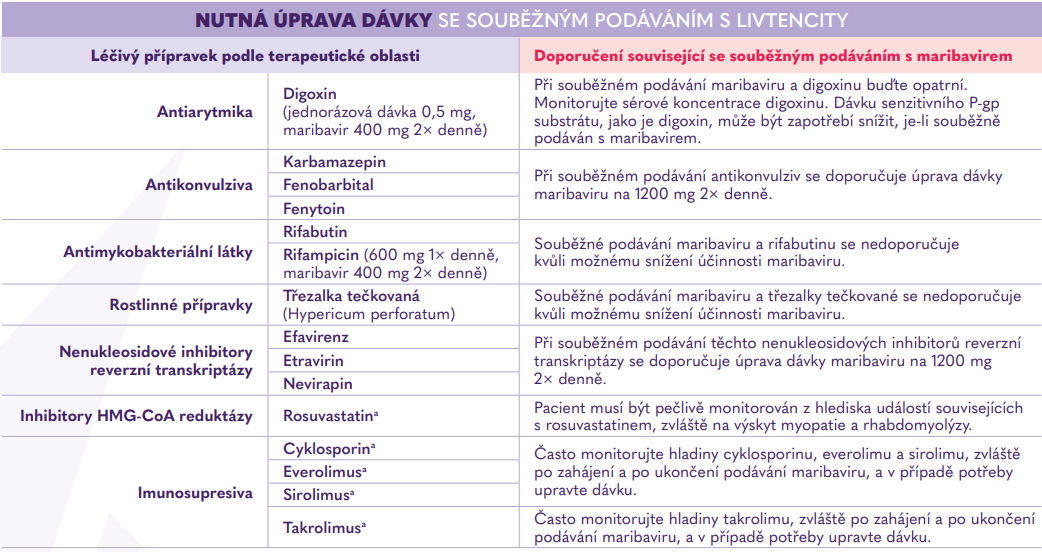
V případě nutnosti úpravy dávkování souběžně podávaných léčivých přípravků při léčbě maribavirem, je třeba jejich dávkování po ukončení léčby maribavirem znovu upravit.1
CMV – cytomegalovirus, SOT – transplantace solidních orgánů, HSCT – transplantace hematopoetických buněk, MBV – maribavir, FOS – foskarnet, V/GCV – val/ganciklovir, R/R – refrakterní, rezistentní, AKI – akutní poškození ledvin, IAT – zkoušejícím lékařem přiřazená léčba, N – počet pacientů.
Reference:
- SPC přípravku LIVTENCITY, datum poslední revize: 05/2025.
- Razonable RR, Oral antiviral drugs for treatment of cytomegalovirus in transplant recipients. Clin Microbiol Infect. 2023 Sep;29(9):1144-1149.
- Chen, S.-J.; Wang, S.-C.; Chen, Y.-C. Challenges, Recent Advances and Perspectives in the Treatment of Human Cytomegalovirus Infections. Trop. Med. Infect. Dis. 2022, 7, 439. https://doi.org/10.3390/tropicalmed7120439.
- Karvunidis T et al. Cytomegalové infekce v intenzivní péči: léčit nebo ignorovat? Anest intenziv Med. 2018;29:275-282.
- Sun K et al. Maribavir: Mechanism of action, clinical, and translational science. Clin Transl Sci. 2024;17:e13696.
- SPC přípravku Cymevene 500 mg, datum poslední revize: 05/2023.
- SPC přípravku Valganciclovir Mylan 450 mg, datum poslední revize: 10/2022.
- SPC přípravku Foscarnet Tillomed, datum poslední revize: 03/2023.
- SPC přípravku Cidofovir Tillomed, datum poslední revize: 12/2020.
- SPC přípravku Prevymis, datum poslední revize: 08/2022.
- Avery RK, et al. Clin Infect Dis. 2022;75:690–701.

